
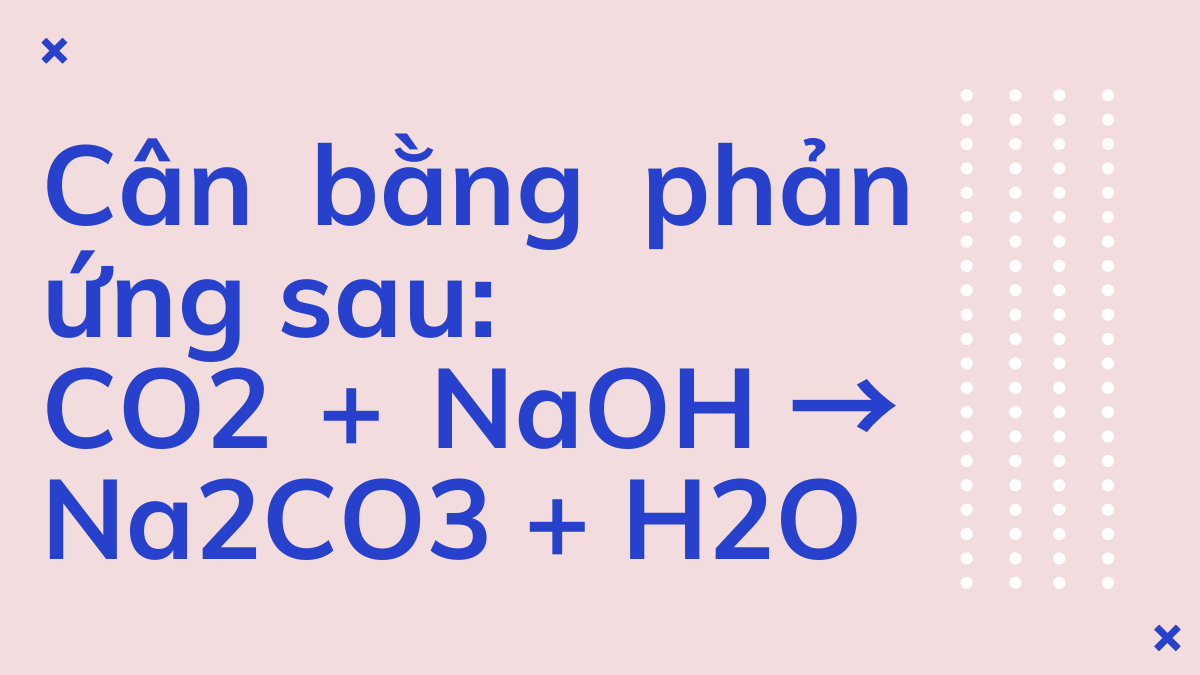
Cân bằng phản ứng sau NaHCO3 + NaOH → Na2CO3 + H2O
Phản ứng hóa học cân bằng là một khái niệm quan trọng trong lĩnh vực hóa học. Trong quá trình phản ứng hóa học, các chất tham gia sẽ tương tác với nhau để tạo ra sản phẩm mới. Để hiểu rõ hơn về cân bằng phản ứng hóa học, chúng ta sẽ tìm hiểu qua ví dụ cụ thể về phản ứng sau: NaHCO3 + NaOH → Na2CO3 + H2O.
Phản ứng hóa học cân bằng
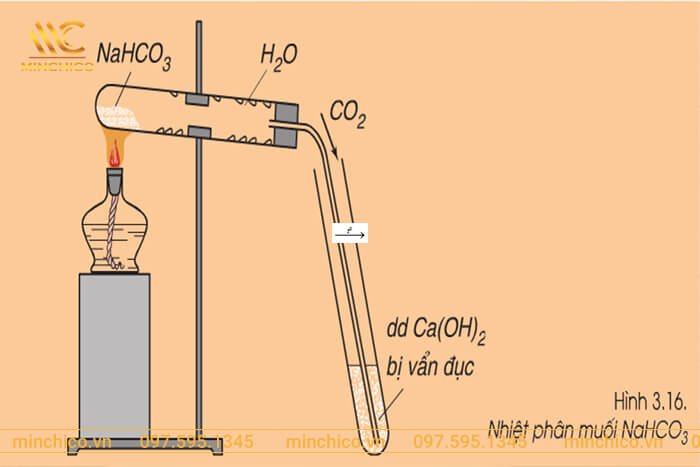
Cân bằng phản ứng NaHCO3 + NaOH → Na2CO3 + H2O
Trong phản ứng trên, NaHCO3 (soda lạnh) và NaOH (natri hidroxit) tác dụng với nhau để tạo ra Na2CO3 (soda ash) và H2O (nước). Đây là một ví dụ về phản ứng trung hòa axit - bazơ trong hóa học.
NaHCO3 + NaOH → Na2CO3 + H2O
Trong phản ứng này, NaHCO3 (muối natri của axit cacbonic) sẽ tác dụng với NaOH (bazơ) để tạo ra Na2CO3 (muối natri của axit cacbonic) và H2O.
Cách cân bằng phản ứng NaHCO3 + NaOH → Na2CO3 + H2O
Để cân bằng phản ứng trên, chúng ta cần xác định hệ số của các chất tham gia và sản phẩm sao cho số nguyên tử của các nguyên tố trên cả hai bên phản ứng là bằng nhau.
Khi cân bằng phản ứng NaHCO3 + NaOH → Na2CO3 + H2O, ta cần điều chỉnh hệ số của các chất sao cho cân bằng:
2NaHCO3 + 2NaOH → Na2CO3 + 2H2O
Theo phản ứng trên, mỗi 2 phân tử soda lạnh và 2 phân tử natri hidroxit sẽ tạo ra 1 phân tử soda ash và 2 phân tử nước.
Phương pháp cân bằng phản ứng hóa học
Cân bằng phản ứng oxi hóa khử
Phản ứng oxi hóa khử là một loại phản ứng hóa học quan trọng có thể được cân bằng bằng cách xác định số oxi hóa của các nguyên tố trong các chất tham gia và sản phẩm.
Trong phản ứng NaHCO3 + NaOH → Na2CO3 + H2O, ta có thể xác định số oxi hóa của cacbon (C) và oxi (O) để cân bằng phản ứng.
Vai trò của cân bằng phản ứng trong hóa học
Cân bằng phản ứng hóa học giúp xác định tỉ lệ chính xác giữa các chất tham gia và sản phẩm trong một phản ứng, từ đó giúp dự đoán hiệu suất của phản ứng và điều chỉnh điều kiện phản ứng để đạt được hiệu suất cao nhất.
Ứng dụng của cân bằng phản ứng trong thực tế
Cân bằng phản ứng hóa học được áp dụng rộng rãi trong nhiều lĩnh vực, từ công nghiệp đến nghiên cứu cơ bản. Việc hiểu và áp dụng cân bằng phản ứng giúp tối ưu hóa quy trình sản xuất, nâng cao hiệu suất và chất lượng sản phẩm.
Cân bằng phản ứng trong sản xuất công nghiệp
Cân bằng phản ứng trong phòng thí nghiệm
Khi thực hiện các phản ứng hóa học trong phòng thí nghiệm, việc cân bằng phản ứng là cực kỳ quan trọng để đảm bảo tính chính xác của kết quả và hạn chế lãng phí vật liệu.
Cân bằng phản ứng trong tự nhiên
Trái đất tự nhiên cũng tồn tại rất nhiều phản ứng hóa học diễn ra mà chúng ta có thể quan sát được hàng ngày, từ quá trình hình thành đá, biển cát đến sự phân hủy sinh học trong tự nhiên. Cân bằng phản ứng giữa các yếu tố hóa học là yếu tố quyết định sự cân bằng tự nhiên trên Trái Đất.
Kết luận
Trên đây là một số kiến thức cơ bản về cân bằng phản ứng hóa học và ví dụ cụ thể về phản ứng NaHCO3 + NaOH → Na2CO3 + H2O. Hi vọng qua bài viết này, bạn đọc đã hiểu rõ hơn về khái niệm cân bằng phản ứng và vai trò quan trọng của nó trong lĩnh vực hóa học.
Mọi thắc mắc quý khách hàng xin vui lòng gửi về số Hotline 1900.868644 hoặc địa chỉ email [email protected] để được giải đáp. Trân trọng!
Link nội dung: https://luathoanhut.vn/can-bang-phan-ung-sau-nahco3-naoh-na2co3-h2o-a24509.html