
Phản ứng hóa học của Ca(HCO3)2 với NaOH
Phản ứng hóa học giữa calcium bicarbonate (Ca(HCO3)2) và sodium hydroxide (NaOH) là một trong những phản ứng quan trọng trong các quá trình hóa học công nghiệp và sinh học. Phản ứng này xảy ra khi Ca(HCO3)2 và NaOH được trộn lẫn với nhau, dẫn đến sự tạo thành một số sản phẩm mới. Hiểu được cơ chế và điều kiện của phản ứng này rất quan trọng trong việc ứng dụng và kiểm soát các quá trình liên quan.
Điều kiện xảy ra phản ứng
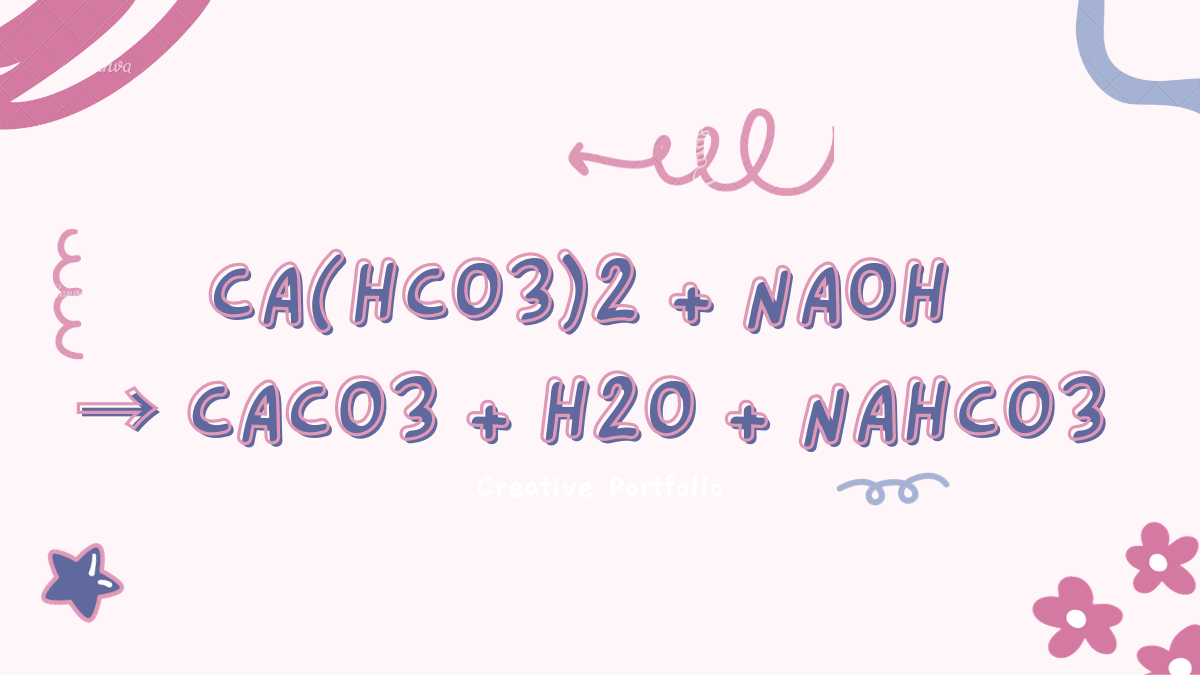
Nhiệt độ và pH
Phản ứng giữa Ca(HCO3)2 và NaOH thường xảy ra ở nhiệt độ thường và ở khoảng pH từ trung tính đến kiềm. Nhiệt độ càng cao, tốc độ phản ứng càng nhanh, nhưng nhiệt độ quá cao có thể làm giảm hiệu suất của phản ứng. Giá trị pH của môi trường phản ứng phải nằm trong khoảng từ 7 đến 14, tức là từ trung tính đến kiềm mạnh.
Nồng độ các chất
Nồng độ của Ca(HCO3)2 và NaOH cũng ảnh hưởng đến tốc độ và hiệu suất của phản ứng. Thông thường, nồng độ của các chất càng cao, tốc độ phản ứng càng nhanh. Tuy nhiên, nếu nồng độ quá cao, sẽ dẫn đến một số vấn đề như kết tủa, ăn mòn thiết bị, v.v. Vì vậy, cần tìm ra nồng độ tối ưu để đạt được hiệu suất cao nhất.
Thời gian phản ứng
Thời gian phản ứng giữa Ca(HCO3)2 và NaOH thường kéo dài từ vài phút đến vài giờ, tùy thuộc vào các điều kiện như nhiệt độ, pH, nồng độ, v.v. Thời gian phản ứng càng ngắn, hiệu suất càng cao, nhưng cần đảm bảo rằng phản ứng đã hoàn thành để thu được sản phẩm mong muốn.
Sản phẩm của phản ứng
Khi Ca(HCO3)2 phản ứng với NaOH, sẽ tạo ra ba sản phẩm chính:
- Calcium carbonate (CaCO3)
- Nước (H2O)
- Sodium bicarbonate (NaHCO3)
Phản ứng hóa học có thể được viết như sau:
Ca(HCO3)2 + 2NaOH → CaCO3 ↓ + 2H2O + NaHCO3
Trong đó:
- Ca(HCO3)2 là calcium bicarbonate
- NaOH là sodium hydroxide
- CaCO3 là calcium carbonate (kết tủa)
- H2O là nước
- NaHCO3 là sodium bicarbonate
Calcium carbonate (CaCO3) là sản phẩm chính của phản ứng, được tạo thành dưới dạng kết tủa trắng. Nước (H2O) và sodium bicarbonate (NaHCO3) cũng được tạo thành như các sản phẩm phụ của phản ứng.
Vai trò của từng chất trong phản ứng
Calcium bicarbonate (Ca(HCO3)2)
Calcium bicarbonate là một chất quan trọng trong phản ứng này. Nó cung cấp ion calcium (Ca2+) và ion bicarbonate (HCO3-) cần thiết cho sự tạo thành CaCO3. Calcium bicarbonate thường xuất hiện trong nước tự nhiên như nước giếng, nước sông, v.v.
Sodium hydroxide (NaOH)
Sodium hydroxide đóng vai trò là chất tham gia phản ứng, cung cấp ion hydroxide (OH-) cần thiết để tạo ra CaCO3 và NaHCO3. NaOH là một chất kiềm mạnh, thường được sử dụng trong các quá trình hóa học công nghiệp và trong sinh hoạt.
Calcium carbonate (CaCO3)
CaCO3 là sản phẩm chính của phản ứng, được tạo thành dưới dạng kết tủa trắng. CaCO3 có nhiều ứng dụng trong các lĩnh vực như xây dựng, công nghiệp, y tế, v.v.
Nước (H2O)
Nước là một sản phẩm phụ của phản ứng, được tạo thành trong quá trình tương tác giữa Ca(HCO3)2 và NaOH.
Sodium bicarbonate (NaHCO3)
NaHCO3 cũng là một sản phẩm phụ của phản ứng. Nó có nhiều ứng dụng trong công nghiệp hóa chất, thực phẩm, y tế, v.v.
Ứng dụng của phản ứng
Phản ứng giữa Ca(HCO3)2 và NaOH có nhiều ứng dụng quan trọng trong các lĩnh vực như:
Xử lý nước
Phản ứng này được sử dụng trong quá trình xử lý nước, đặc biệt là loại bỏ độ cứng của nước do sự có mặt của ion Ca2+ và HCO3-. Bằng cách cho NaOH tương tác với Ca(HCO3)2, CaCO3 được tạo thành và kết tủa ra, giúp làm giảm độ cứng của nước.
Sản xuất vật liệu xây dựng
CaCO3 là một trong những nguyên liệu chính để sản xuất xi măng, vữa, gạch, v.v. Phản ứng giữa Ca(HCO3)2 và NaOH là một trong các nguồn cung cấp CaCO3 cho các quá trình sản xuất vật liệu xây dựng.
Công nghiệp hóa chất
NaHCO3 là một sản phẩm phụ của phản ứng, được sử dụng rộng rãi trong công nghiệp hóa chất, như trong sản xuất chất tẩy rửa, thuốc tân dược, thực phẩm, v.v.
Neutralization
Phản ứng giữa Ca(HCO3)2 và NaOH có thể được sử dụng để trung hoà axit hoặc kiềm trong các quá trình xử lý nước thải, khử ô nhiễm, v.v.
Ứng dụng khác
Ngoài các ứng dụng trên, phản ứng này còn có các ứng dụng khác như trong công nghiệp giấy, sản xuất thức ăn chăn nuôi, v.v.
Cân bằng phản ứng hóa học
Phương trình cân bằng của phản ứng giữa Ca(HCO3)2 và NaOH như sau:
Ca(HCO3)2 + 2NaOH → CaCO3 ↓ + 2H2O + NaHCO3
Ở đây, Ca(HCO3)2 và NaOH là các chất tham gia phản ứng, CaCO3, H2O và NaHCO3 là các sản phẩm của phản ứng.
Để cân bằng phương trình này, ta cần đảm bảo rằng số nguyên tử của mỗi nguyên tố (Ca, C, H, O, Na) phải bằng nhau ở hai vế. Việc cân bằng phương trình giúp ta xác định được tỉ lệ mol của các chất tham gia và sản phẩm, từ đó có thể tính toán khối lượng hoặc nồng độ của chúng.
Tính toán khối lượng và nồng độ của các chất
Dựa trên phương trình cân bằng của phản ứng, ta có thể thực hiện các tính toán về khối lượng và nồng độ của các chất tham gia và sản phẩm.
Tính toán khối lượng
Giả sử ta có một lượng Ca(HCO3)2 nhất định, ta có thể tính toán khối lượng CaCO3, H2O và NaHCO3 tạo thành dựa trên tỉ lệ mol trong phương trình cân bằng.
Ví dụ: Nếu có 100 g Ca(HCO3)2, thì:
- Khối lượng CaCO3 tạo thành: 100 g x (100 g/162 g) = 61,73 g
- Khối lượng H2O tạo thành: 100 g x (36 g/162 g) x 2 = 44,44 g
- Khối lượng NaHCO3 tạo thành: 100 g x (84 g/162 g) = 51,85 g
Tính toán nồng độ
Ngoài tính toán khối lượng, ta cũng có thể tính toán nồng độ của các chất tham gia và sản phẩm trong dung dịch.
Ví dụ: Nếu ta pha 100 g Ca(HCO3)2 vào 1 lít nước, ta có thể tính được nồng độ của Ca(HCO3)2 trong dung dịch là:
- Nồng độ Ca(HCO3)2 = 100 g / (1 L x 162 g/mol) = 0,62 mol/L
Tương tự, ta có thể tính nồng độ của các sản phẩm CaCO3, H2O và NaHCO3 trong dung dịch.
Các phương pháp thực hiện phản ứng
Phản ứng giữa Ca(HCO3)2 và NaOH có thể được thực hiện bằng nhiều phương pháp khác nhau, tùy thuộc vào mục đích và quy mô của quá trình.
Phương pháp khuấy trộn
Đây là phương pháp thông dụng nhất, trong đó Ca(HCO3)2 và NaOH được trộn lẫn với nhau bằng cách khuấy đều trong một bể phản ứng. Phương pháp này thường áp dụng trong các quy trình xử lý nước, sản xuất vật liệu xây dựng, v.v.
Phương pháp liên tục
Trong phương pháp này, dung dịch Ca(HCO3)2 và dung dịch NaOH được bơm liên tục vào một thiết bị phản ứng, như một bể lắng hoặc một cột phản ứng. Sản phẩm được thu nhận liên tục ở đầu ra. Phương pháp này phù hợp với các quy trình sản xuất quy mô lớn.
Phương pháp kết tủa
Phản ứng giữa Ca(HCO3)2 và NaOH có thể được thực hiện bằng cách làm tăng nồng độ hoặc thay đổi điều kiện (như pH, nhiệt độ) để tạo ra kết tủa CaCO3. Phương pháp này thường được sử dụng trong quá trình xử lý nước cứng hoặc sản xuất vật liệu xây dựng.
Các phương pháp khác
Ngoài các phương pháp trên, phản ứng này còn có thể được thực hiện bằng các phương pháp như lắng, lọc, sấy, v.v. tùy thuộc vào mục đích và quy trình cụ thể.
Những lưu ý khi thực hiện phản ứng
Khi thực hiện phản ứng giữa Ca(HCO3)2 và NaOH, cần lưu ý một số điểm sau:
- Đảm bảo điều kiện phản ứng (nhiệt độ, pH, nồng độ) phù hợp để tối ưu hóa hiệu suất và tốc độ của phản ứng.
- Kiểm soát tốt quá trình kết tủa CaCO3 để tránh các vấn đề như kết tủa quá nhanh, tắc nghẽn thiết bị, v.v.
- Quản lý tốt sản phẩm NaHCO3 để tránh các vấn đề như ăn mòn thiết bị, v.v.
- Xử lý, thu hồi và tái sử dụng các sản phẩm phụ của phản ứng (như nước) để nâng cao hiệu quả và tính bền vững của quá trình.
- Tuân thủ các quy định về an toàn, môi trường khi thực hiện phản ứng, đảm bảo sức khỏe cho người vận hành và bảo vệ môi trường.
- Theo dõi và kiểm soát chặt chẽ các thông số của quá trình để đảmPhản ứng hóa học của Ca(HCO3)2 với NaOH là một phản ứng trung hoà quan trọng trong ngành hóa học. Nguyên liệu cho phản ứng này bao gồm Canxi bicarbonate (Ca(HCO3)2) và Natri hydroxit (NaOH), tạo ra Canxi cacbonat (CaCO3), nước (H2O) và Natri bicarbonate (NaHCO3) như là sản phẩm chính. Phản ứng này có nhiều ứng dụng trong công nghiệp, từ sản xuất chất tẩy rửa, thuốc tân dược đến thực phẩm.
Điều kiện xảy ra phản ứng
Để phản ứng xảy ra hiệu quả, cần điều chỉnh các điều kiện sau:
- Nhiệt độ: Thường phản ứng xảy ra ở nhiệt độ phòng.
- pH: Cần duy trì pH cần thiết để khích lệ việc trung hoà axit hay kiềm.
- Nồng độ: Sự pha loãng hoặc tăng nồng độ chất tham gia cũng có thể ảnh hưởng đến tốc độ và hiệu suất của phản ứng.
Sản phẩm của phản ứng
Sản phẩm chính của phản ứng là Canxi cacbonat (CaCO3), nước (H2O) và Natri bicarbonate (NaHCO3). CaCO3 là một chất rắn kết tủa không tan trong nước, H2O là dung môi quen thuộc, còn NaHCO3 có thể tiếp tục tham gia trong các phản ứng trung hoà khác.
Công thức phân tử và tính chất của các sản phẩm:
- CaCO3: Canxi cacbonat
- Khối lượng phân tử: 100,09 g/mol
- Tính chất: Dạng hạt tinh thể trắng, không tan trong nước.
- H2O: Nước
- Khối lượng phân tử: 18,02 g/mol
- Tính chất: Dung môi quan trọng trong hầu hết các phản ứng hóa học.
- NaHCO3: Natri bicarbonate
- Khối lượng phân tử: 84,01 g/mol
- Tính chất: Dạng bột màu trắng, tan trong nước, có khả năng kiềm hóa.
Vai trò của từng chất trong phản ứng:
- Ca(HCO3)2: Là chất có khả năng trung hoà axit, cung cấp ion Canxi.
- NaOH: Là chất kiềm mạnh, giúp trung hoà axit, tạo ra Natri bicarbonate và Canxi cacbonat.
- CaCO3: Là kết tủa không tan trong nước, được sử dụng trong nhiều ứng dụng công nghiệp.
- H2O: Dung môi hóa học quan trọng, tiếp tục cung cấp điều kiện cho các phản ứng khác diễn ra.
- NaHCO3: Là một sản phẩm phụ, được sử dụng rộng rãi trong công nghiệp hóa chất, như trong sản xuất chất tẩy rửa, thuốc tân dược, thực phẩm, v.v.
Ứng dụng của phản ứng
Phản ứng trung hoà giữa Ca(HCO3)2 và NaOH có nhiều ứng dụng:
- Trung hoà: Có thể sử dụng để trung hoà axit hoặc kiềm trong các quá trình xử lý nước, khử ô nhiễm, v.v.
- Công nghiệp: Có thể áp dụng trong công nghiệp giấy, sản xuất thức ăn chăn nuôi, v.v.
Cân bằng phản ứng hóa học
Phương trình cân bằng của phản ứng giữa Ca(HCO3)2 và NaOH: $$Ca(HCO3)_2 + 2NaOH → CaCO_3 ↓ + 2H_2O + NaHCO_3$$
Để cân bằng phản ứng, cần đảm bảo số mol của mỗi nguyên tố (Ca, C, H, O, Na) đều bằng nhau ở cả hai vế của phương trình. Việc cân bằng phương trình giúp xác định tỉ lệ mol của các chất tham gia và sản phẩm.
Tính toán khối lượng và nồng độ của các chất:
- Tính toán khối lượng: Dựa trên tỷ lệ mol trong phản ứng, có thể tính toán khối lượng của CaCO3, H2O và NaHCO3 tạo thành từ một lượng Ca(HCO3)2 nhất định.
- Tính toán nồng độ: Cũng có thể tính nồng độ của các chất tham gia và sản phẩm trong dung dịch để theo dõi và điều chỉnh quá trình phản ứng.
Các phương pháp thực hiện phản ứng
Phản ứng giữa Ca(HCO3)2 và NaOH có thể được thực hiện qua các phương pháp sau:
Phương pháp khuấy trộn
Trộn đều Ca(HCO3)2 và NaOH trong một bể phản ứng thông qua quá trình khuấy trộn. Phương pháp này thường được áp dụng trong các quy trình xử lý nước, sản xuất vật liệu xây dựng.
Phương pháp liên tục
Dùng thiết bị bơm để truyền dung dịch Ca(HCO3)2 và NaOH vào thiết bị phản ứng, lấy sản phẩm ở đầu ra liên tục. Phương pháp này thích hợp với các quy trình sản xuất quy mô lớn.
Phương pháp kết tủa
Có thể tạo ra kết tủa CaCO3 thông qua việc thay đổi nồng độ hoặc điều kiện (như pH, nhiệt độ). Phương pháp này hữu ích trong xử lý nước cứng hoặc sản xuất vật liệu xây dựng.
Những lưu ý khi thực hiện phản ứng
Khi thực hiện phản ứng giữa Ca(HCO3)2 và NaOH, cần tuân thủ các lưu ý sau để đảm bảo hiệu suất và an toàn:
- Điều chỉnh điều kiện phản ứng để tối ưu hiệu quả và tốc độ phản ứng.
- Kiểm soát quá trình kết tủa để tránh các vấn đề như tắc nghẽn thiết bị.
- Quản lý sản phẩm NaHCO3 để tránh ăn mòn thiết bị.
- Xử lý và tái sử dụng sản phẩm phụ để giảm lượng chất thải.
- Tuân thủ các quy định về an toàn lao động và bảo vệ môi trường.
- Theo dõi chặt chẽ quá trình để điều chỉnh và cải thiện quá trình sản xuất.
Kết luận
Phản ứng hóa học giữa Ca(HCO3)2 và NaOH không chỉ là một quy trình trung hoà đơn giản mà còn là cơ sở cho nhiều ứng dụng trong công nghiệp. Việc hiểu rõ về điều kiện xảy ra, sản phẩm, và ứng dụng của phản ứng này giúp tối ưu hóa quá trình sản xuất và bảo vệ môi trường. Đồng thời, các biện pháp lưu ý khi thực hiện phản ứng giúp đảm bảo an toàn và hiệu quả cho quy trình sản xuất.
Mọi thắc mắc quý khách hàng xin vui lòng gửi về số Hotline 1900.868644 hoặc địa chỉ email [email protected] để được giải đáp. Trân trọng!
Link nội dung: https://luathoanhut.vn/phan-ung-hoa-hoc-cua-cahco32-voi-naoh-a24646.html