
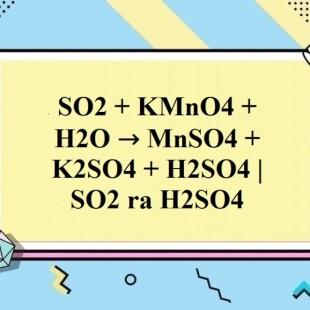
Cân bằng phương trình hóa học SO2 + KMnO4 + H2O → MnSO4 + K2SO4 + H2SO4
Phản ứng hóa học giữa dioxide lưu huỳnh (SO2) và permanganat kali (KMnO4) trong môi trường axit là một trong những phản ứng quan trọng và phổ biến trong hóa học. Việc cân bằng phương trình hóa học của phản ứng này không chỉ là một phần cơ bản trong việc học và nghiên cứu hóa học, mà còn có nhiều ứng dụng thực tiễn trong nhiều lĩnh vực khác nhau như xử lý nước thải, sản xuất hóa chất, và công nghiệp.
Trong bài viết này, chúng ta sẽ tìm hiểu chi tiết về phản ứng giữa SO2 và KMnO4 trong môi trường axit, bao gồm các khía cạnh như điều chế muối sunfat của mangan (II) và kali, vai trò của nước (H2O) trong phản ứng, cách cân bằng phương trình hóa học, ứng dụng thực tế, và một số lưu ý quan trọng khi làm bài tập liên quan đến phản ứng này.
Phản ứng hóa học giữa SO2 và KMnO4 trong môi trường axit
Phản ứng hóa học giữa SO2 và KMnO4 trong môi trường axit là một phản ứng oxy hóa - khử, trong đó SO2 được oxy hóa thành H2SO4, còn KMnO4 được khử thành MnSO4. Phương trình hóa học tổng quát của phản ứng này có thể viết như sau:
SO2 + 2KMnO4 + 2H2SO4 → 2MnSO4 + K2SO4 + 2H2O
Trong phản ứng này, SO2 đóng vai trò là chất khử, còn KMnO4 đóng vai trò là chất oxy hóa. Khi thêm H2SO4 vào hệ, nó sẽ tạo ra môi trường axit, giúp cho phản ứng diễn ra thuận lợi hơn.
Điều chế muối sunfat của mangan (II) và kali từ SO2 và KMnO4
Một trong những ứng dụng quan trọng của phản ứng giữa SO2 và KMnO4 trong môi trường axit là việc điều chế muối sunfat của mangan (II) và kali. Quá trình này như sau:
- Đầu tiên, SO2 và KMnO4 phản ứng với nhau trong môi trường axit (H2SO4) để tạo ra MnSO4 và K2SO4:
SO2 + 2KMnO4 + 2H2SO4 → 2MnSO4 + K2SO4 + 2H2O
- Sau đó, dung dịch thu được sẽ được lọc hoặc để kết tủa để thu nhận các muối sunfat này.
Quá trình này cho phép thu nhận MnSO4 và K2SO4 với độ tinh khiết cao, và các muối này có nhiều ứng dụng trong công nghiệp hóa chất, y học, và nông nghiệp.
Vai trò của H2O trong phản ứng giữa SO2 và KMnO4
Trong phản ứng giữa SO2 và KMnO4 trong môi trường axit, H2O đóng vai trò là một trong những sản phẩm của phản ứng. Cụ thể, H2O được tạo ra khi SO2 được oxy hóa thành H2SO4, như thể hiện trong phương trình hóa học:
SO2 + 2KMnO4 + 2H2SO4 → 2MnSO4 + K2SO4 + 2H2O
Sự có mặt của H2O trong phản ứng là rất quan trọng, vì nó làm cho phản ứng diễn ra hoàn chỉnh và tạo thành các sản phẩm mong muốn. Nếu không có H2O, phản ứng sẽ không thể hoàn thành và sẽ tạo ra các sản phẩm khác.
Ngoài ra, H2O cũng đóng vai trò trong việc duy trì môi trường axit cần thiết cho phản ứng. Khi H2SO4 được tạo ra, nó sẽ giữ cho môi trường phản ứng ở trong môi trường axit, qua đó thúc đẩy quá trình oxy hóa - khử giữa SO2 và KMnO4.
Cân bằng phương trình hóa học cho phản ứng giữa SO2 và KMnO4
Để cân bằng phương trình hóa học cho phản ứng giữa SO2 và KMnO4 trong môi trường axit, chúng ta cần phải xác định số oxy hóa của các nguyên tử trong phản ứng. Sau đó, sử dụng phương pháp bán phản ứng để cân bằng phương trình.
Áp dụng phương pháp bán phản ứng để cân bằng phương trình SO2 + KMnO4 + H2O
Các bước cụ thể như sau:
- Viết phương trình ion cho các chất tham gia phản ứng:
- SO2 (khử): SO2 + 2H2O → SO4^(2-) + 4H+ + 2e-
- KMnO4 (oxy hóa): MnO4^(-) + 8H+ + 5e- → Mn^(2+) + 4H2O
- Cân bằng phương trình bán phản ứng:
- Oxy hóa: MnO4^(-) + 8H+ + 5e- → Mn^(2+) + 4H2O
- Khử: SO2 + 2H2O → SO4^(2-) + 4H+ + 2e-
- Nhân các phương trình bán phản ứng lại với nhau để đảm bảo số electron bị mất bằng số electron được tạo ra:
- Oxy hóa: 2MnO4^(-) + 16H+ + 10e- → 2Mn^(2+) + 8H2O
- Khử: 5SO2 + 10H2O → 5SO4^(2-) + 20H+ + 10e-
- Cộng các phương trình bán phản ứng lại với nhau:
- 2MnO4^(-) + 16H+ + 5SO2 + 10H2O → 2Mn^(2+) + 5SO4^(2-) + 24H+
- Đơn giản hóa phương trình:
- 2KMnO4 + 5SO2 + 2H2SO4 → 2MnSO4 + K2SO4 + 2H2O
Vậy, phương trình cân bằng hóa học cho phản ứng giữa SO2 và KMnO4 trong môi trường axit (H2SO4) là:
SO2 + 2KMnO4 + 2H2SO4 → 2MnSO4 + K2SO4 + 2H2O
Ý nghĩa của việc cân bằng phương trình hóa học phản ứng giữa SO2 và KMnO4
Việc cân bằng phương trình hóa học cho phản ứng giữa SO2 và KMnO4 trong môi trường axit có ý nghĩa quan trọng trong học tập và nghiên cứu hóa học:
- Xác định các sản phẩm của phản ứng: Qua việc cân bằng phương trình, chúng ta có thể xác định chính xác các sản phẩm được tạo ra trong phản ứng, bao gồm MnSO4 và K2SO4.
- Hiểu rõ cơ chế phản ứng: Khi cân bằng phương trình, chúng ta phải xác định quá trình oxy hóa - khử diễn ra, từ đó hiểu rõ cơ chế phản ứng hóa học.
- Tính toán định lượng: Việc cân bằng phương trình cho phép chúng ta tính toán định lượng các chất tham gia phản ứng và sản phẩm thu được, qua đó áp dụng vào các bài toán hóa học.
- Ứng dụng trong thực tế: Phản ứng giữa SO2 và KMnO4 trong môi trường axit có nhiều ứng dụng thực tế, như xử lý nước thải, sản xuất hóa chất, v.v. Việc cân bằng phương trình là cơ sở quan trọng để hiểu và ứng dụng phản ứng này.
Tóm lại, việc cân bằng phương trình hóa học cho phản ứng giữa SO2 và KMnO4 trong môi trường axit là một bước quan trọng, giúp chúng ta hiểu sâu hơn về cơ chế, tính toán định lượng, và ứng dụng của phản ứng này trong thực tế.
Ứng dụng của phản ứng giữa SO2 và KMnO4 trong thực tế
Phản ứng giữa SO2 và KMnO4 trong môi trường axit có nhiều ứng dụng quan trọng trong thực tế, bao gồm:
Xử lý nước thải
Một trong những ứng dụng chính của phản ứng này là trong xử lý nước thải. SO2 là một chất gây ô nhiễm môi trường, vì vậy việc oxy hóa SO2 thành H2SO4 bằng KMnO4 trong môi trường axit là một phương pháp hiệu quả để loại bỏ SO2 khỏi nước thải.
Quá trình xử lý diễn ra như sau:
- Nước thải chứa SO2 được cho vào bể phản ứng.
- KMnO4 và H2SO4 được thêm vào để khởi động phản ứng oxy hóa SO2.
- SO2 sẽ được oxy hóa thành H2SO4, còn KMnO4 sẽ bị khử thành MnSO4.
- Cuối cùng, dung dịch được lọc để loại bỏ các sản phẩm của phản ứng.
Phương pháp này giúp loại bỏ hiệu quả SO2 khỏi nước thải, góp phần bảo vệ môi trường.
Sản xuất hóa chất
Phản ứng giữa SO2 và KMnO4 trong môi trường axit còn được sử dụng để sản xuất các hóa chất quan trọng như MnSO4 và K2SO4. Các muối này có nhiều ứng dụng trong công nghiệp hóa chất, y học, và nông nghiệp.
Ví dụ, MnSO4 được sử dụng làm phân bón vi lượng, chất tẩy rửa, và trong sản xuất pin. K2SO4 cũng được sử dụng làm phân bón và trong sản xuất thuỷ tinh, gốm sứ.
Vì vậy, việc điều chế các muối sunfat từ phản ứng giữa SO2 và KMnO4 là một ứng dụng quan trọng trong công nghiệp hóa chất.
Các ứng dụng khác
Ngoài ra, phản ứng giữa SO2 và KMnO4 còn có các ứng dụng khác như:
- Trong y học: KMnO4 được sử dụng như một chất khử trùng và thuốc sát khuẩn.
- Trong công nghiệp luyện kim: SO2 được sử dụng để chiết xuất kim loại từ quặng.
- Trong công nghiệp giấy: SO2 được sử dụng trong quá trình tẩy trắng giấy.
Như vậy, phản ứng giữa SO2 và KMnO4 trong môi trường axit có nhiều ứng dụng quan trọng trong thực tế, từ xử lý ô nhiễm đến sản xuất hóa chất và các ứng dụng khác.
Lưu ý khi cân bằng phương trình phản ứng giữa SO2 và KMnO4
Khi cân bằng phương trình hóa học cho phản ứng giữa SO2 và KMnO4 trong môi trường axit, cần lưu ý một số điểm sau:
- Xác định số oxy hóa: Cần xác định chính xác số oxy hóa của các nguyên tử tham gia phản ứng, đặc biệt là Mn trong KMnO4 và S trong SO2.
- Viết phương trình ion: Viết phương trình ion riêng cho quá trình oxy hóa và khử sẽ giúp cân bằng phương trình dễ dàng hơn.
- Sử dụng phương pháp bán phản ứng: Phương pháp bán phản ứng là phương pháp hiệu quả giúp cân bằng phương trình hóa học một cách đơn giản và nhanh chóng.
- Cân nhắc điều kiện: Trong việc cân bằng phương trình hóa học, cần xác định rõ điều kiện phản ứng, đặc biệt là môi trường axit hay kiềm.
- Kiểm tra lại kết quả: Sau khi cân bằng phương trình, cần kiểm tra lại kết quả để đảm bảo tính chính xác và đầy đủ của phản ứng.
Những lưu ý trên sẽ giúp bạn cân bằng phương trình hóa học cho phản ứng giữa SO2 và KMnO4 một cách hiệu quả và chính xác.
Các dạng bài tập liên quan đến cân bằng phương trình phản ứng giữa SO2 và KMnO4
Khi học về phản ứng giữa SO2 và KMnO4, có thể gặp các dạng bài tập sau:
Bài tập 1: Cân bằng phương trình hóa học
Cho phản ứng: SO2 + KMnO4 + H2SO4 → MnSO4 + K2SO4 + H2O Hãy cân bằng phương trình trên trong môi trường axit.
Giải:
- Xác định số oxy hóa: S trong SO2 từ -2 lên +4, Mn trong KMnO4 từ +7 xuống +2.
- Viết phương trình ion:
- Quá trình khử: 5SO2 + 2KMnO4 + 2H2O → 5SO4^(2-) + 2Mn^(2+) + 4H^+
- Quá trình oxy hóa: 2MnO4^(-) + 16H+ + 5SO2 + 10H2O → 2Mn^(2+) + 5SO4^(2-) + 24H+
- Đơn giản hóa:
- 2KMnO4 + 5SO2 + 2H2O → 2MnSO4 + K2SO4 + 2H2O
Vậy, phương trình cân bằng hóa học là: SO2 + 2KMnO4 + 2H2SO4 → 2MnSO4 + K2SO4 + 3H2O.
Bài tập 2: Tính toán định lượng
Nếu có 4 mol SO2 và 3 mol KMnO4 tham gia phản ứng, hỏi produc
Giải: Theo phương trình đã cân bằng: SO2 + 2KMnO4 + 2H2SO4 → 2MnSO4 + K2SO4 + 3H2O Ta thấy tỉ lệ mol giữa SO2 và KMnO4 là 1:2, vì vậy cần 8 mol KMnO4 để phản ứng hoàn toàn với 4 mol SO2. Do đó, nếu chỉ có 3 mol KMnO4, chỉ có 1,5 mol SO2 phản ứng hoàn toàn.
Thông qua các bài tập này, bạn có thể rèn luyện kỹ năng cân bằng phương trình hóa học và áp dụng vào việc tính toán định lượng.
Những dạng toán nâng cao liên quan đến phản ứng giữa SO2 và KMnO4
Ngoài các bài tập cơ bản về cân bằng phương trình hóa học, bạn cũng có thể gặp các dạng toán nâng cao liên quan đến phản ứng giữa SO2 và KMnO4, như:
- Tính toán hằng số cân bằng K của phản ứng.
- Xác định nồng độ của các chất trong dung dịch sau phản ứng.
- Tính toán hiệu suất phản ứng dựa trên số mol chất ban đầu và sản phẩm thu được.
Những dạng toán này yêu cầu kiến thức chuyên sâu về phản ứng hóa học và khả năng áp dụng các công thức toán học vào hóa học.
Kết luận
Trên đây là những kiến thức cơ bản về phản ứng giữa SO2 và KMnO4 trong môi trường axit, bao gồm cân bằng phương trình hóa học, ý nghĩa và ứng dụng của phản ứng, cũng như các dạng bài tập liên quan. Hi vọng rằng thông qua bài viết này, bạn đã có cái nhìn tổng quan và chi tiết về chủ đề này. Chúc bạn học tốt!
Mọi thắc mắc quý khách hàng xin vui lòng gửi về số Hotline 1900.868644 hoặc địa chỉ email [email protected] để được giải đáp. Trân trọng!
Link nội dung: https://luathoanhut.vn/can-bang-phuong-trinh-hoa-hoc-so2-kmno4-h2o-mnso4-k2so4-h2so4-a24663.html