
Tính Chất và Phản Ứng của Ethyne (C2H2)
Ethyne, còn được gọi là acetylene, là một hợp chất hydrocarbon đơn giản với công thức hóa học C2H2. Nó là một loại khí không màu, không mùi và dễ cháy. Ethyne có một số tính chất hóa học đặc biệt khiến nó trở thành một chất phản ứng hữu ích trong nhiều ngành công nghiệp.
Acetylen Phản Ứng với Nước
Trong điều kiện bình thường, ethyne không phản ứng với nước. Tuy nhiên, trong điều kiện có xúc tác thích hợp, nó có thể phản ứng với nước để tạo ra etanal (axetoandehit). Phản ứng này được gọi là phản ứng hidrat hóa của ethyne.
Phản Ứng Hidrat Hóa của Ethyne
- Phản ứng hidrat hóa của ethyne diễn ra theo cơ chế cộng đồng.
- Xúc tác thông thường được sử dụng trong phản ứng này là ion thủy ngân (II), ion đồng (I) hoặc axit sunfuric loãng.
- Phương trình phản ứng:
C2H2 + H2O → CH3CHO
Tính Tan của Acetylen trong Nước
Ethyne rất ít tan trong nước. Độ tan của nó chỉ khoảng 1,2% theo thể tích ở nhiệt độ 25 °C. Độ tan của ethyne trong nước tăng khi nhiệt độ tăng. Ở nhiệt độ 100 °C, độ tan của ethyne trong nước tăng lên khoảng 2,5%.
Phản Ứng Cân Bằng của C2H2, H2O, CO2 và H2O
Trong điều kiện nhiệt độ cao, ethyne có thể phản ứng với nước, carbon dioxide và hydro để tạo ra một hỗn hợp cân bằng. Phản ứng này được gọi là phản ứng chuyển hóa hơi nước của ethyne.
Phản Ứng Chuyển Hóa Hơi Nước của Ethyne
- Phản ứng chuyển hóa hơi nước của ethyne là một phản ứng thuận nghịch.
- Vị trí cân bằng của phản ứng phụ thuộc vào nhiệt độ, áp suất và nồng độ của các chất phản ứng.
- Phương trình cân bằng phản ứng:
C2H2 + H2O ⇌ 2CO + 2H2
Loại Phản Ứng của C2H2 + O2 → CO2 + H2O
Khi ethyne đốt cháy hoàn toàn trong oxy, nó tạo ra carbon dioxide và nước. Phản ứng này là phản ứng tỏa nhiệt mạnh mẽ và giải phóng một lượng lớn năng lượng. Loại phản ứng này được gọi là phản ứng oxy hóa.
Phản Ứng Oxy Hóa của Ethyne
- Phản ứng oxy hóa của ethyne là một phản ứng tỏa nhiệt mạnh.
- Enthalpy phản ứng đốt cháy hoàn toàn ethyne là -1300 kJ/mol.
- Phương trình phản ứng:
C2H2 + 5O2 → 2CO2 + 2H2O
Loại Phản Ứng của C2H2O2 + CO2 + H2O
Khi ethyne tác dụng với oxy già (H2O2) trong điều kiện có xúc tác thích hợp, nó tạo ra axit axetic (CH3COOH) và nước. Loại phản ứng này được gọi là phản ứng oxy hóa của ethyne.
Phản Ứng Oxy Hóa của Ethyne với Oxy Già
- Phản ứng oxy hóa của ethyne với oxy già là một phản ứng tỏa nhiệt.
- Xúc tác thường được sử dụng trong phản ứng này là ion vanađi (V).
- Phương trình phản ứng:
C2H2 + 2H2O2 → CH3COOH + H2O
Phản Ứng của C2H2 và CH3CHO
Khi ethyne tác dụng với etanal (CH3CHO) trong điều kiện có xúc tác thích hợp, nó tạo ra butan-2-on (CH3CH2COCH3). Loại phản ứng này được gọi là phản ứng cộng của ethyne.
Phản Ứng Cộng của Ethyne với Etanal
- Phản ứng cộng của ethyne với etanal là một phản ứng thuận nghịch.
- Xúc tác thường được sử dụng trong phản ứng này là ion đồng (I) hoặc ion palladium (II).
- Phương trình phản ứng:
C2H2 + CH3CHO → CH3CH2COCH3
Phản Ứng của CH3CH2CHO và H2
Khi butan-2-on (CH3CH2COCH3) tác dụng với hydro trong điều kiện có xúc tác thích hợp, nó tạo ra butan-2-ol (CH3CH2CH(OH)CH3). Loại phản ứng này được gọi là phản ứng cộng của butan-2-on.
Phản Ứng Cộng của Butan-2-on với Hydro
- Phản ứng cộng của butan-2-on với hydro là một phản ứng thuận nghịch.
- Xúc tác thường được sử dụng trong phản ứng này là niken hoặc platin.
- Phương trình phản ứng:
CH3CH2COCH3 + H2 → CH3CH2CH(OH)CH3
Phản Ứng của C2H2 và CH3COOH
Khi ethyne tác dụng với axit axetic (CH3COOH) trong điều kiện có xúc tác thích hợp, nó tạo ra etyl axetat (CH3COOC2H5). Loại phản ứng này được gọi là phản ứng este hóa của ethyne.
Phản Ứng Este Hóa của Ethyne với Axit Axetic
- Phản ứng este hóa của ethyne với axit axetic là một phản ứng thuận nghịch.
- Xúc tác thường được sử dụng trong phản ứng này là axit sunfuric đặc.
- Phương trình phản ứng:
```C2H2 + CH3COOH → CH3COOC2H5
Ethyne, hay còn được gọi là acetylene, là một hợp chất hydrocarbon đơn giản với công thức hóa học C2H2. Đây là một khí không màu, không mùi, và dễ cháy. Ethyne có một số tính chất hóa học đặc biệt khiến nó trở thành một chất phản ứng hữu ích trong nhiều ngành công nghiệp.
Acetylen Phản Ứng với Nước
Phản Ứng Hidrat Hóa của Ethyne
Phản ứng hidrat hóa của ethyne diễn ra theo cơ chế cộng đồng khi có xúc tác thích hợp như ion thủy ngân (II), ion đồng (I) hoặc axit sunfuric loãng. Phương trình phản ứng cho phản ứng hidrat hóa ethyne là: C2H2 + H2O → CH3CHO.
Tính Tan của Acetylen trong Nước
Ethyne rất ít tan trong nước, chỉ khoảng 1,2% theo thể tích ở nhiệt độ 25 °C. Tuy nhiên, độ tan của ethyne trong nước tăng khi nhiệt độ tăng lên. Ở nhiệt độ 100 °C, độ tan của ethyne trong nước tăng lên khoảng 2,5%.
Phản Ứng Cân Bằng của C2H2, H2O, CO2 và H2O
Phản Ứng Chuyển Hóa Hơi Nước của Ethyne
Trong điều kiện nhiệt độ cao, ethyne có thể phản ứng với nước, carbon dioxide, và hydro để tạo ra một hỗn hợp cân bằng. Phản ứng này là phản ứng chuyển hóa hơi nước của ethyne. Phương trình cân bằng phản ứng: C2H2 + H2O ⇌ 2CO + 2H2.
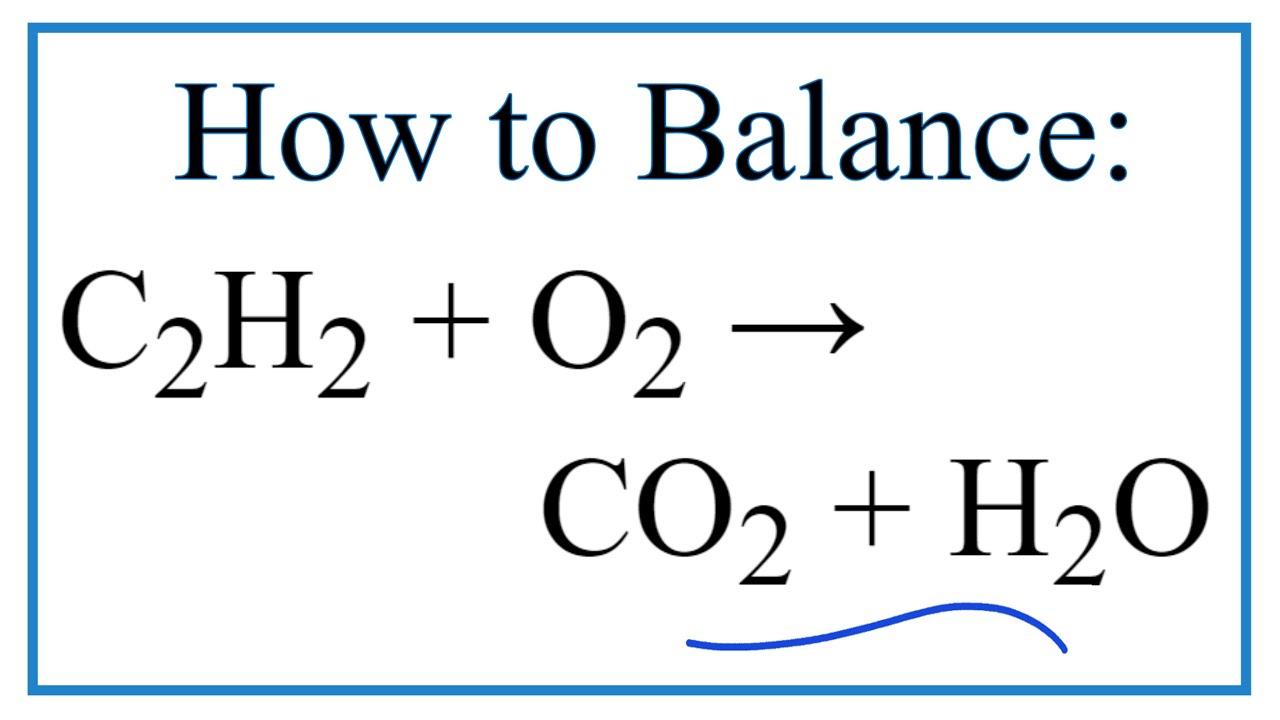
Loại Phản Ứng của C2H2 + O2 → CO2 + H2O
Phản Ứng Oxy Hóa của Ethyne
Khi ethyne đốt cháy hoàn toàn trong oxy, nó tạo ra carbon dioxide và nước. Phản ứng này là phản ứng tỏa nhiệt mạnh mẽ và giải phóng một lượng lớn năng lượng. Enthalpy phản ứng đốt cháy hoàn toàn ethyne là -1300 kJ/mol. Phương trình phản ứng: C2H2 + 5O2 → 2CO2 + 2H2O.
Loại Phản Ứng của C2H2O2 + CO2 + H2O
Phản Ứng Oxy Hóa của Ethyne với Oxy Già
Khi ethyne tác dụng với oxy già (H2O2) trong điều kiện có xúc tác, nó tạo ra axit axetic (CH3COOH) và nước. Phương trình phản ứng: C2H2 + 2H2O2 → CH3COOH + H2O.
Phản Ứng của C2H2 và CH3CHO
Phản Ứng Cộng của Ethyne với Etanal
Khi ethyne tác dụng với etanal (CH3CHO) trong điều kiện có xúc tác thích hợp, nó tạo ra butan-2-on (CH3CH2COCH3). Phương trình phản ứng: C2H2 + CH3CHO → CH3CH2COCH3.
Phản Ứng của CH3CH2CHO và H2
Phản Ứng Cộng của Butan-2-on với Hydro
Khi butan-2-on (CH3CH2COCH3) tác dụng với hydro trong điều kiện có xúc tác thích hợp, nó tạo ra butan-2-ol (CH3CH2CH(OH)CH3). Phương trình phản ứng: CH3CH2COCH3 + H2 → CH3CH2CH(OH)CH3.
Phản Ứng của C2H2 và CH3COOH
Phản Ứng Este Hóa của Ethyne với Axit Axetic
Khi ethyne tác dụng với axit axetic (CH3COOH) trong điều kiện có xúc tác thích hợp, nó tạo ra etyl axetat (CH3COOC2H5). Phương trình phản ứng: C2H2 + CH3COOH → CH3COOC2H5.
Kết Luận
Như vậy, ethyne (acetylene) là một hợp chất hydrocarbon quan trọng với nhiều tính chất và phản ứng đa dạng. Việc hiểu rõ các tính chất và phản ứng của ethyne giúp chúng ta áp dụng chất này vào các ứng dụng công nghiệp và hóa học một cách hiệu quả và an toàn.
Mọi thắc mắc quý khách hàng xin vui lòng gửi về số Hotline 1900.868644 hoặc địa chỉ email [email protected] để được giải đáp. Trân trọng!
Link nội dung: https://luathoanhut.vn/tinh-chat-va-phan-ung-cua-ethyne-c2h2-a24804.html
