
Cân bằng phương trình Al(OH)3 + HCl → AlCl3 + H2O
Phương trình hóa học là một công cụ quan trọng giúp chúng ta mô tả, hiểu và dự đoán các quá trình hóa học diễn ra trong cuộc sống hàng ngày cũng như trong các ứng dụng công nghiệp. Trong số các phương trình hóa học, phương trình Al(OH)3 + HCl → AlCl3 + H2O là một ví dụ điển hình để minh họa cho quá trình cân bằng phương trình.
Việc cân bằng phương trình hóa học cho phản ứng Al(OH)3 + HCl → AlCl3 + H2O không chỉ là một bài tập đơn giản mà còn có ý nghĩa quan trọng trong việc hiểu sâu hơn về các quá trình hóa học và ứng dụng của chúng trong thực tế. Trong bài viết này, chúng ta sẽ tìm hiểu chi tiết về cách cân bằng phương trình này, vai trò của nó, các bước thực hiện, lưu ý, ví dụ cụ thể và ý nghĩa ứng dụng của nó trong nhiều lĩnh vực khác nhau.
Phương trình cân bằng hóa học của phản ứng Al(OH)3 + HCl → AlCl3 + H2O
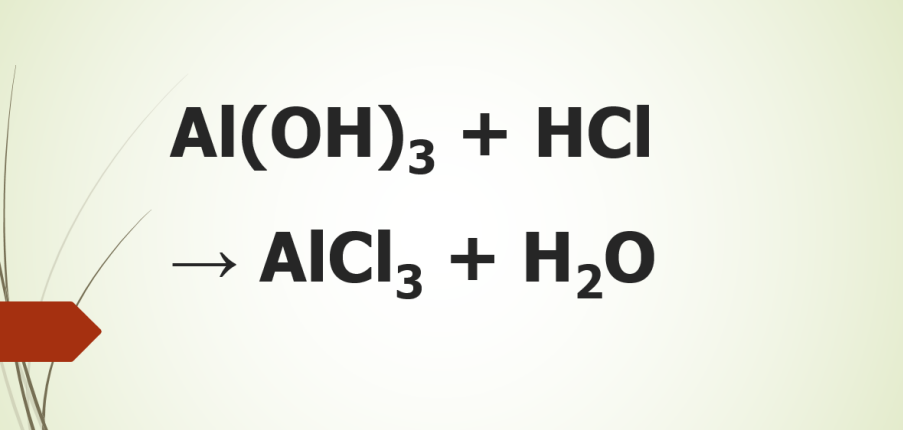
Phương trình hóa học Al(OH)3 + HCl → AlCl3 + H2O mô tả quá trình phản ứng giữa hydroxid nhôm (Al(OH)3) và axit hydrochloric (HCl) để tạo thành clorua nhôm (AlCl3) và nước (H2O).
Các thành phần tham gia phản ứng
- Al(OH)3 (Hydroxid nhôm): Đây là một chất rắn trắng, không màu, có công thức hóa học là Al(OH)3. Hydroxid nhôm là một chất base, được sử dụng rộng rãi trong nhiều lĩnh vực như xử lý nước, sản xuất giấy, công nghiệp hóa chất, v.v.
- HCl (Axit hydrochloric): Đây là một dung dịch aqueous của khí hydro clorua (HCl), có màu không màu, mùi chua, là một chất axit mạnh. Axit hydrochloric được sử dụng rộng rãi trong các quy trình công nghiệp, trong y tế, và trong cuộc sống hàng ngày.
- AlCl3 (Clorua nhôm): Đây là một chất rắn tinh thể, không màu, ở nhiệt độ thường. Clorua nhôm là một chất Lewis axit, được sử dụng trong nhiều ứng dụng hóa học như xử lý nước, lọc dầu, sản xuất nhôm, v.v.
- H2O (Nước): Là một chất lỏng không màu, không mùi, là một chất phổ biến và quan trọng trong tự nhiên và trong các quy trình công nghiệp.
Diễn biến của phản ứng
Khi hydroxid nhôm (Al(OH)3) và axit hydrochloric (HCl) được trộn lẫn với nhau, các phân tử sẽ tương tác và tạo thành các sản phẩm mới là clorua nhôm (AlCl3) và nước (H2O). Phản ứng này có thể được mô tả bằng phương trình hóa học sau:
Al(OH)3 + HCl → AlCl3 + H2O
Trong phản ứng này, hydroxid nhôm (Al(OH)3) đóng vai trò là chất bị oxy hóa (chất khử), trong khi axit hydrochloric (HCl) đóng vai trò là chất oxy hóa (chất oxi). Sản phẩm của phản ứng là clorua nhôm (AlCl3) và nước (H2O).
Để cân bằng phương trình hóa học này, chúng ta cần xác định hệ số của các nguyên tố (Al, Cl, H, O) trên cả hai vế của phương trình sao cho tổng số nguyên tử của mỗi nguyên tố trên hai vế đều bằng nhau.
Cân bằng phương trình hóa học có vai trò gì?
Cân bằng phương trình hóa học là một bước quan trọng trong việc mô tả và hiểu các quá trình hóa học. Nó có những vai trò chính sau:
1. Xác định đúng các sản phẩm của phản ứng
Khi cân bằng phương trình hóa học, chúng ta sẽ xác định chính xác các sản phẩm của phản ứng hóa học, đảm bảo rằng tổng số nguyên tử của mỗi nguyên tố trên hai vế đều bằng nhau. Điều này giúp chúng ta hiểu rõ hơn về bản chất của phản ứng hóa học.
2. Tính toán định lượng các sản phẩm
Từ phương trình cân bằng, chúng ta có thể tính toán định lượng các sản phẩm của phản ứng, ví dụ như khối lượng, thể tích hoặc số mol của các sản phẩm. Điều này rất quan trọng trong các ứng dụng công nghiệp và phân tích hóa học.
3. Dự đoán hướng diễn biến của phản ứng
Phương trình cân bằng cung cấp thông tin về các chất tham gia phản ứng và sản phẩm tạo thành. Từ đó, chúng ta có thể dự đoán hướng diễn biến của phản ứng, xác định các yếu tố ảnh hưởng đến sự cân bằng và tối ưu hóa điều kiện để đạt được hiệu suất phản ứng cao.
4. Tính toán các thông số nhiệt động học
Từ phương trình cân bằng, chúng ta có thể tính toán các thông số nhiệt động học như enthalpy phản ứng, entropy, năng lượng hoạt hóa, v.v. Các thông số này giúp chúng ta hiểu sâu hơn về cơ chế và động học của phản ứng hóa học.
5. Ứng dụng trong các lĩnh vực khoa học và công nghiệp
Khả năng cân bằng phương trình hóa học là cơ sở cho việc nghiên cứu, phát triển và ứng dụng các quá trình hóa học trong nhiều lĩnh vực như hóa học, vật lý, sinh học, y dược, kỹ thuật hóa học, v.v.
Vì vậy, việc cân bằng phương trình hóa học, bao gồm phương trình Al(OH)3 + HCl → AlCl3 + H2O, là một kỹ năng cơ bản và quan trọng trong học tập và nghiên cứu hóa học.
Các bước cân bằng phương trình hóa học Al(OH)3 + HCl → AlCl3 + H2O
Để cân bằng phương trình hóa học Al(OH)3 + HCl → AlCl3 + H2O, chúng ta cần thực hiện các bước sau:
1. Xác định các nguyên tố tham gia
Trước tiên, chúng ta cần xác định các nguyên tố có mặt trong phương trình, bao gồm: Al, H, O, Cl.
2. Viết phương trình chưa cân bằng
Phương trình chưa cân bằng sẽ có dạng:
Al(OH)3 + HCl → AlCl3 + H2O
3. Cân bằng số nguyên tử của từng nguyên tố
- Cân bằng số nguyên tử Al:
- Trên vế trái có 1 nguyên tử Al
- Trên vế phải có 1 nguyên tử Al
- Số nguyên tử Al đã cân bằng
- Cân bằng số nguyên tử Cl:
- Trên vế trái có 1 nguyên tử Cl
- Trên vế phải có 3 nguyên tử Cl
- Cần thêm 2 nguyên tử Cl vào vế trái
- Cân bằng số nguyên tử H:
- Trên vế trái có 3 nguyên tử H
- Trên vế phải có 2 nguyên tử H
- Cần bớt 1 nguyên tử H ở vế trái
- Cân bằng số nguyên tử O:
- Trên vế trái có 3 nguyên tử O
- Trên vế phải có 1 nguyên tử O
- Cần bớt 2 nguyên tử O ở vế trái
4. Viết phương trình cân bằng
Sau khi cân bằng số nguyên tử của từng nguyên tố, chúng ta có phương trình cân bằng như sau:
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Lưu ý khi cân bằng phương trình Al(OH)3 + HCl → AlCl3 + H2O
Khi cân bằng phương trình hóa học Al(OH)3 + HCl → AlCl3 + H2O, cần lưu ý các điểm sau:
1. Xác định chính xác các thành phần tham gia
Trước khi cân bằng phương trình, cần xác định chính xác các chất tham gia phản ứng (Al(OH)3, HCl) và sản phẩm tạo thành (AlCl3, H2O).
2. Cân bằng số nguyên tử từng nguyên tố
Phải cân bằng số nguyên tử của từng nguyên tố (Al, Cl, H, O) trên cả hai vế phương trình. Không được bỏ sót bất kỳ nguyên tố nào.
3. Sử dụng hệ số thích hợp
Khi cân bằng phương trình, cần sử dụng các hệ số thích hợp để khiến số nguyên tử của từng nguyên tố trên hai vế phương trình bằng nhau.
4. Kiểm tra lại kết quả
Sau khi cân bằng xong phương trình, nên kiểm tra lại kết quả để đảm bảo rằng số nguyên tử của mỗi nguyên tố trên hai vế đều bằng nhau.
5. Hiểu rõ bản chất của phản ứng
Ngoài việc cân bằng phương trình, cần hiểu rõ bản chất của phản ứng hóa học, vai trò của từng chất tham gia và cơ chế của quá trình diễn ra.
Việc tuân thủ các lưu ý trên sẽ giúp bạn cân bằng phương trình hóa học Al(OH)3 + HCl → AlCl3 + H2O một cách chính xác và hiệu quả.
Phương pháp cân bằng phương trình phản ứng Al(OH)3 + HCl → AlCl3 + H2O

Để cân bằng phương trình hóa học Al(OH)3 + HCl → AlCl3 + H2O, chúng ta có thể áp dụng các phương pháp sau:
1. Phương pháp tăng - giảm số nguyên tử
Bước 1: Xác định các nguyên tố xuất hiện trong phương trình. Bước 2: Viết phương trình chưa cân bằng. Bước 3: Cân bằng số nguyên tử của từng nguyên tố bằng cách tăng hoặc giảm hệ số thích hợp. Bước 4: Kiểm tra lại kết quả.
2. Phương pháp cân bằng theo chu trình electron
Bước 1: Xác định các nguyên tố tham gia và xác định số oxy hóa của chúng. Bước 2: Cân bằng số nguyên tử của nguyên tố oxy bằng cách thêm nước (H2O). Bước 3: Cân bằng số nguyên tử của nguyên tố hydro bằng cách thêm axit (HCl). Bước 4: Cân bằng số nguyên tử của các nguyên tố khác. Bước 5: Kiểm tra lại kết quả.
3. Phương pháp sử dụng hệ số thích hợp
Bước 1: Xác định các nguyên tố tham gia và đếm số nguyên tử của từng nguyên tố. Bước 2: Viết phương trình chưa cân bằng. Bước 3: Sử dụng các hệ số thích hợp để cân bằng số nguyên tử của từng nguyên tố. Bước 4: Kiểm tra lại kết quả và điều chỉnh nếu cần thiết.
4. Phương pháp sử dụng định luật bảo toàn nguyên tố
Bước 1: Xác định các nguyên tố tham gia và sản phẩm tạo thành trong phản ứng. Bước 2: Lập bảng bảo toàn nguyên tố để xác định số nguyên tử của từng nguyên tố trên hai vế phương trình. Bước 3: Sử dụng hệ số thích hợp để cân bằng số nguyên tử của các nguyên tố. Bước 4: Kiểm tra lại kết quả và điều chỉnh nếu cần thiết.
Việc áp dụng các phương pháp cân bằng phương trình hóa học Al(OH)3 + HCl → AlCl3 + H2O sẽ giúp bạn hiểu rõ quy trình cân bằng và thực hiện phản ứng một cách chính xác.
Ví dụ cân bằng phương trình Al(OH)3 + HCl → AlCl3 + H2O
Để minh họa cho việc cân bằng phương trình hóa học Al(OH)3 + HCl → AlCl3 + H2O, chúng ta sẽ thực hiện các bước sau:
- Xác định các nguyên tố tham gia: Al, H, O, Cl.
- Viết phương trình chưa cân bằng: Al(OH)3 + HCl → AlCl3 + H2O.
- Cân bằng số nguyên tử của từng nguyên tố:
- Al: 1 nguyên tử ở cả hai vế.
- Cl: 1 nguyên tử ở vế trái, 3 nguyên tử ở vế phải.
- H: 3 nguyên tử ở vế trái, 2 nguyên tử ở vế phải.
- O: 3 nguyên tử ở vế trái, 1 nguyên tử ở vế phải.
- Viết phương trình cân bằng: Al(OH)3 + 3HCl → AlCl3 + 3H2O.
Qua ví dụ này, bạn có thể thấy cách cân bằng phương trình hóa học Al(OH)3 + HCl → AlCl3 + H2O một cách chi tiết và logic.
Ý nghĩa của việc cân bằng phương trình hóa học Al(OH)3 + HCl → AlCl3 + H2O
Việc cân bằng phương trình hóa học Al(OH)3 + HCl → AlCl3 + H2O đem lại nhiều ý nghĩa quan trọng như:
1. Đảm bảo tính chính xác của phản ứng
Việc cân bằng phương trình giúp đảm bảo rằng số nguyên tử của từng nguyên tố trên hai vế phản ứng bằng nhau, từ đó đảm bảo tính chính xác của quá trình hóa học diễn ra.
2. Hiểu rõ hơn về quá trình phản ứng
Khi cân bằng phương trình, bạn sẽ hiểu rõ hơn về cơ chế và quy luật của phản ứng hóa học, từ đó nắm vững kiến thức lý thuyết và ứng dụng vào thực tiễn.
3. Áp dụng vào thực tế
Việc cân bằng phương trình hóa học Al(OH)3 + HCl → AlCl3 + H2O có thể áp dụng vào nhiều lĩnh vực khác nhau như sản xuất hóa chất, công nghiệp, y học, nghiên cứu khoa học, v.v.
Ứng dụng của phương trình cân bằng hóa học Al(OH)3 + HCl → AlCl3 + H2O
Phương trình cân bằng hóa học Al(OH)3 + HCl → AlCl3 + H2O không chỉ là một bài toán lý thuyết mà còn có nhiều ứng dụng thực tiễn như:
1. Trong công nghiệp hóa chất
Phương trình này có thể được áp dụng trong quá trình sản xuất hóa chất và xử lý chất thải để đảm bảo an toàn và hiệu quả.
2. Trong y học
Việc cân bằng phản ứng hóa học là cơ sở để hiểu và điều chỉnh các quá trình sinh học trong cơ thể, từ đó áp dụng vào điều trị và chẩn đoán bệnh tật.
3. Trong nghiên cứu khoa học
Cân bằng phương trình hóa học là bước quan trọng trong nghiên cứu và phát triển các công nghệ mới, từ vật liệu đến dược phẩm.
Việc hiểu và áp dụng phương trình cân bằng hóa học Al(OH)3 + HCl → AlCl3 + H2O sẽ mang lại nhiều lợi ích và ứng dụng trong cuộc sống hàng ngày.
Tài liệu tham khảo về cân bằng phương trình Al(OH)3 + HCl → AlCl3 + H2O
- Atkins, P., & Jones, L. (2008). Chemical Principles: The Quest for Insight. W. H. Freeman and Company.
- Chang, R. (2010). Chemistry (11th ed.). McGraw-Hill Science/Engineering/Math.
- Ebbing, D. D., & Gammon, S. D. (2016). General Chemistry. Cengage Learning.
Những tài liệu trên là những nguồn thông tin đáng tin cậy để bạn tìm hiểu sâu hơn về quá trình cân bằng phương trình hóa học và ứng dụng của nó trong thực tế.
Kết luận
Trên đây là một cái nhìn tổng quan về quá trình cân bằng phương trình hóa học Al(OH)3 + HCl → AlCl3 + H2O. Việc cân bằng phương trình không chỉ là một kỹ năng cơ bản mà còn là nền tảng quan trọng trong học tập và nghiên cứu hóa học. Qua việc áp dụng các phương pháp cân bằng, bạn sẽ hiểu rõ hơn về quy trình phản ứng, ứng dụng vào nhiều lĩnh vực khác nhau và đóng góp vào sự phát triển của xã hội.
Mọi thắc mắc quý khách hàng xin vui lòng gửi về số Hotline 1900.868644 hoặc địa chỉ email [email protected] để được giải đáp. Trân trọng!
Link nội dung: https://luathoanhut.vn/can-bang-phuong-trinh-aloh3-hcl-alcl3-h2o-a24856.html