1. Phản ứng đốt cháy C2H5OH
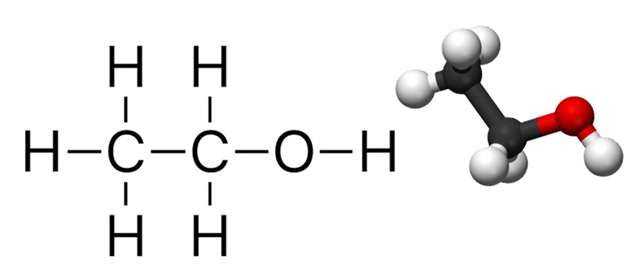
1.1. Sơ đồ phản ứng
C2H5OH + O2 → CH3COOH + H2O
1.2. Chất tham gia và sản phẩm
a. Chất tham gia:
- Ethanol (C2H5OH): Là một ancol bậc nhất có công thức phân tử C2H6O.
- Oxy (O2): Là một khí không màu, không mùi và không vị.
b. Sản phẩm:
- Axit axetic (CH3COOH): Là một axit hữu cơ yếu, có công thức phân tử C2H4O2.
- Nước (H2O): Là một hợp chất vô cơ phổ biến và thiết yếu cho sự sống.
2. Cân bằng phản ứng
Để cân bằng phản ứng, chúng ta phải đảm bảo rằng số lượng nguyên tử của mỗi nguyên tố ở vế trái bằng với số lượng nguyên tử của nguyên tố đó ở vế phải.
2.1. Cân bằng nguyên tử cacbon
Số nguyên tử cacbon ở vế trái là 2, ở vế phải là 2, vậy phản ứng đã cân bằng về nguyên tử cacbon.
2.2. Cân bằng nguyên tử hydro
Số nguyên tử hydro ở vế trái là 6, ở vế phải là 4, vậy ta nhân hệ số CH3COOH với 2.
2C2H5OH + 3O2 → 2CH3COOH + 3H2O
Số nguyên tử hydro ở vế trái là 10, ở vế phải là 10, vậy phản ứng đã cân bằng về nguyên tử hydro.
2.3. Cân bằng nguyên tử oxy
Số nguyên tử oxy ở vế trái là 3, ở vế phải là 6, vậy ta nhân hệ số O2 với 3.
2C2H5OH + 3O2 → 2CH3COOH + 3H2O
Số nguyên tử oxy ở vế trái là 9, ở vế phải là 9, vậy phản ứng đã cân bằng về nguyên tử oxy.
3. Ý nghĩa của phản ứng đốt cháy C2H5OH
3.1. Giải phóng năng lượng
Phản ứng đốt cháy etanol là một phản ứng tỏa nhiệt, nghĩa là nó giải phóng năng lượng dưới dạng nhiệt. Năng lượng này có thể được sử dụng để làm ấm, nấu ăn hoặc sản xuất điện.
3.2. Ứng dụng trong động cơ
Động cơ đốt trong của ô tô và máy móc hoạt động bằng cách đốt cháy nhiên liệu, thường là xăng hoặc dầu diesel. Quá trình đốt cháy này cung cấp năng lượng để đẩy piston, từ đó tạo ra chuyển động.
3.3. Ứng dụng trong bếp gas
Bếp gas sử dụng khí hóa lỏng (LPG), một loại hỗn hợp của propane và butan, như nhiên liệu. Quá trình đốt cháy LPG tạo ra năng lượng để đun nấu thức ăn.
4. Các yếu tố ảnh hưởng đến phản ứng đốt cháy C2H5OH

4.1. Nhiệt độ
Nhiệt độ càng cao thì phản ứng đốt cháy càng diễn ra nhanh hơn. Điều này là do nhiệt độ cung cấp năng lượng hoạt hóa cần thiết để các phân tử phản ứng phá vỡ liên kết và tạo thành các liên kết mới.
4.2. Áp suất
Áp suất tăng lên cũng có thể làm tăng tốc độ phản ứng. Điều này là do áp suất cao hơn làm tăng tần suất va chạm giữa các phân tử phản ứng.
4.3. Chất xúc tác
Chất xúc tác là chất làm tăng tốc độ phản ứng mà không bị tiêu thụ. Trong phản ứng đốt cháy etanol, các chất xúc tác thường được sử dụng bao gồm platinum và palladium.
5. Các biện pháp đảm bảo an toàn khi thực hiện phản ứng
5.1. Thực hiện trong môi trường mở
Phản ứng đốt cháy etanol tạo ra khí CO2, vì vậy cần thực hiện phản ứng trong môi trường mở để tránh ngạt thở.
5.2. Sử dụng thiết bị bảo hộ
Khi thực hiện phản ứng, nên đeo găng tay, khẩu trang và kính bảo hộ để bảo vệ bản thân khỏi các hóa chất độc hại.
5.3. Bảo quản đúng cách
Các hóa chất tham gia và sản phẩm của phản ứng cần được bảo quản đúng cách trong các bình kín để tránh rò rỉ và đánh lửa.
6. Tái chế và xử lý chất thải
6.1. Tái chế
Chai, lọ và hộp chứa hóa chất nên được tái chế sau khi sử dụng.
6.2. Xử lý chất thải
Chất thải của phản ứng, bao gồm các chất rắn và lỏng, cần được xử lý đúng cách. Các chất rắn có thể được chôn lấp, trong khi các chất lỏng có thể được trung hòa và xả thải theo quy định của địa phương.
Kết luận
Phản ứng đốt cháy etanol là một phản ứng hóa học quan trọng với nhiều ứng dụng thực tế. Việc hiểu rõ về phản ứng này, bao gồm cả cách cân bằng, ý nghĩa và các yếu tố ảnh hưởng, là rất quan trọng để sử dụng an toàn và hiệu quả hóa chất này. Bằng cách thực hiện các biện pháp phòng ngừa thích hợp và xử lý chất thải đúng cách, chúng ta có thể giảm thiểu rủi ro và tác động đến môi trường.
Mọi thắc mắc quý khách hàng xin vui lòng gửi về số Hotline 1900.868644 hoặc địa chỉ email [email protected] để được giải đáp. Trân trọng!

















