
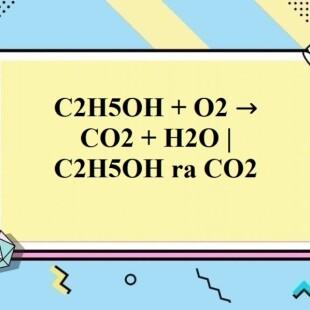
Ethanol, hay còn gọi là rượu etylic, là một hợp chất hữu cơ có công thức hóa học C2H5OH. Khi đốt cháy ethanol trong không khí hoặc oxy nguyên chất, phản ứng xảy ra theo phương trình hóa học sau:
C2H5OH + 3O2 → 2CO2 + 3H2O + nhiệt
Kiểu Phản Ứng Đốt Cháy Ethanol (C2H5OH → CO2 + H2O)
Phản ứng đốt cháy ethanol là phản ứng oxi hóa khử, trong đó ethanol đóng vai trò là chất khử, còn oxy đóng vai trò là chất oxi hóa. Phản ứng này diễn ra theo cơ chế phản ứng bậc một, với tốc độ phản ứng phụ thuộc vào nồng độ của cả ethanol và oxy.
Ví dụ minh họa:
- Khi đốt cháy một ngọn nến, ethanol (trong sáp nến) phản ứng với oxy trong không khí, tạo ra khí cacbonic (CO2) và hơi nước (H2O), đồng thời giải phóng nhiệt lượng làm nóng không khí xung quanh.
Nhiệt Phản Ứng Đốt Cháy Ethanol (C2H5OH → CO2 + H2O + nhiệt)
Lượng nhiệt giải phóng trong phản ứng đốt cháy ethanol được gọi là nhiệt phản ứng. Nhiệt phản ứng của ethanol được xác định bằng nhiệt lượng kế và có giá trị là -1366,8 kJ/mol. Dấu âm cho biết đây là phản ứng tỏa nhiệt.
Giá Trị Nhiệt Phản Ứng Đốt Cháy Ethanol
| Giá Trị | Ý Nghĩa |
| --- | --- |
| -1366,8 kJ/mol | Lượng nhiệt giải phóng khi đốt cháy 1 mol ethanol trong điều kiện chuẩn |
Giá trị nhiệt phản ứng đốt cháy ethanol cho biết lượng nhiệt giải phóng khi đốt cháy một mol ethanol trong điều kiện chuẩn. Giá trị này có ý nghĩa quan trọng trong việc tính toán hiệu suất của các quá trình đốt cháy ethanol, cũng như trong thiết kế các thiết bị sử dụng năng lượng từ ethanol.
Biến Thiên Nhiệt Phản Ứng Đốt Cháy Ethanol (C2H5OH → CO2 + H2O)
Biến thiên nhiệt phản ứng là sự thay đổi về nhiệt lượng của hệ thống khi phản ứng xảy ra. Đối với phản ứng đốt cháy ethanol, biến thiên nhiệt phản ứng có giá trị bằng nhiệt phản ứng, tức là -1366,8 kJ/mol. Điều này có nghĩa là khi đốt cháy 1 mol ethanol, hệ thống giải phóng ra môi trường xung quanh 1366,8 kJ nhiệt lượng.
Cân Bằng Nhiệt Của Phản Ứng Đốt Cháy Ethanol (C2H5OH → CO2 + H2O + nhiệt)
Cân bằng nhiệt của phản ứng đốt cháy ethanol có thể được biểu diễn bằng phương trình sau:
Nhiệt lượng của ethanol + Nhiệt lượng của oxy = Nhiệt lượng của carbon dioxide + Nhiệt lượng của hơi nước
Phương trình này cho thấy rằng tổng nhiệt lượng của các chất phản ứng (ethanol và oxy) bằng tổng nhiệt lượng của các sản phẩm phản ứng (carbon dioxide và hơi nước).
Cân Bằng Phương Trình Hóa Học Của Phản Ứng Đốt Cháy Ethanol (C2H5OH + O2 → CO2 + H2O)
Phương trình hóa học của phản ứng đốt cháy ethanol có thể được cân bằng theo các bước sau:
- Xác định số nguyên tử của mỗi nguyên tố ở cả hai vế phương trình:
- Carbon: 2 ở vế trái, 1 ở vế phải
- Hydro: 6 ở vế trái, 2 ở vế phải
- Oxy: 1 ở vế trái, 4 ở vế phải
- Cân bằng số nguyên tử từng nguyên tố bằng cách thêm hệ số vào trước các chất:
- Nhân 2 vào CO2: 2CO2
- Nhân 3 vào H2O: 3H2O
- Kiểm tra lại số nguyên tử của mỗi nguyên tố ở cả hai vế phương trình:
- Carbon: 2 ở vế trái, 2 ở vế phải
- Hydro: 6 ở vế trái, 6 ở vế phải
- Oxy: 1 + 6 = 7 ở vế trái, 8 ở vế phải
- Cân bằng số nguyên tử oxy bằng cách thêm hệ số vào trước O2:
- Nhân 3 vào O2: 3O2
- Kiểm tra lại số nguyên tử của mỗi nguyên tố ở cả hai vế phương trình:
- Carbon: 2 ở vế trái, 2 ở vế phải
- Hydro: 6 ở vế trái, 6 ở vế phải
- Oxy: 1 + 6 = 7 ở vế trái, 8 ở vế phải
Phương trình hóa học đã được cân bằng như sau:
C2H5OH + 3O2 → 2CO2 + 3H2O
Kết Luận
Phản ứng đốt cháy ethanol là một phản ứng hóa học quan trọng có nhiều ứng dụng trong đời sống thực tế. Việc hiểu rõ về phản ứng này, bao gồm kiểu phản ứng, nhiệt phản ứng, cân bằng nhiệt và cân bằng phương trình hóa học, có ý nghĩa rất lớn trong việc sử dụng ethanol một cách hiệu quả và an toàn.
Mọi thắc mắc quý khách hàng xin vui lòng gửi về số Hotline 1900.868644 hoặc địa chỉ email [email protected] để được giải đáp. Trân trọng!

















