Sự điện li trong hóa học
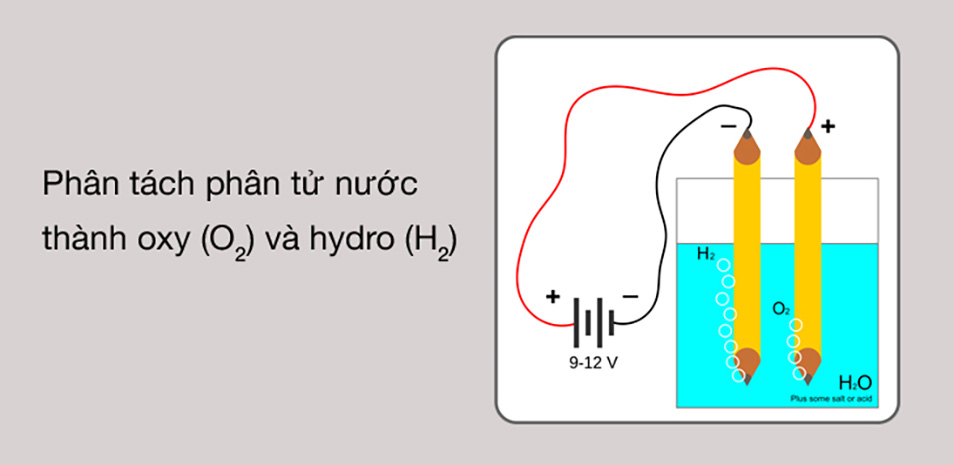
Trong hóa học, sự điện li được chia thành hai loại chính:
Điện li axit-bazơ
Quá trình axit hoặc bazơ phản ứng với nước để tạo ra ion H+ (axit) hoặc OH- (bazơ).
Phương trình điện li của axit mạnh:
HA + H2O → H3O+ + A-
Phương trình điện li của bazơ mạnh:
B + H2O → OH- + BH+
Điện li muối
Quá trình muối hòa tan trong dung môi phân cực để tạo ra các ion dương và âm.
Phương trình điện li của muối:
MX → M+ + X-
trong đó:
- M là kim loại
- X là phi kim
Trắc nghiệm về sự điện li
Câu 1: Phân tử nào sau đây điện li hoàn toàn trong nước? (A) HCl (B) CH3OH (C) NaCl (D) C6H12O6
Câu 2: Cặp ion nào sau đây không điện li hoàn toàn trong nước? (A) Na+ và Cl- (B) H+ và OH- (C) NH4+ và NO3- (D) CH3COO- và Na+
Đáp án:Câu 1: (A) HCl Câu 2: (C) NH4+ và NO3-
Sự điện li của muối
Muối là hợp chất ion được tạo thành từ kim loại và phi kim. Khi muối hòa tan trong dung môi phân cực như nước, chúng phân tách thành các ion riêng biệt.
Ví dụ:
- NaCl (muối ăn) → Na+ + Cl-
- CuSO4 (đồng sunfat) → Cu2+ + SO42-
Khái niệm về sự điện li
Mức độ điện li (α): Là tỷ lệ phần trăm các phân tử chất điện li phân tách thành các ion trong dung dịch.
Hệ số điện li (i): Là số lượng ion tạo thành khi một phân tử điện li phân tách.
Mức độ điện li là gì?
Mức độ điện li được biểu thị bằng ký hiệu α và được tính theo công thức:
α = (Số mol chất điện li phân tách thành ion) / (Số mol chất điện li ban đầu)
Giá trị của α:
- α = 0: Chất không điện li
- 0 < α < 1: Chất điện li yếu
- α = 1: Chất điện li mạnh
Những nhân tố ảnh hưởng đến sự điện li
Có nhiều nhân tố ảnh hưởng đến sự điện li của một chất, bao gồm:
- Bản chất của chất điện li: Chất điện li mạnh có xu hướng điện li hoàn toàn, trong khi chất điện li yếu chỉ điện li một phần.
- Dung môi: Dung môi phân cực mạnh có thể làm tăng sự điện li của chất điện li.
- Nhiệt độ: Nhiệt độ tăng làm tăng sự điện li của chất điện li.
- Nồng độ: Nồng độ chất điện li tăng làm giảm sự điện li.
- Sự có mặt của ion chung: Sự có mặt của ion chung làm giảm sự điện li của chất điện li.
Ý nghĩa của sự điện li
Sự điện li đóng một vai trò quan trọng trong nhiều quá trình hóa học và sinh học, bao gồm:
- Phản ứng hóa học: Sự điện li tạo ra các ion, là hạt cơ bản tham gia phản ứng hóa học.
- Conductivity điện: Dung dịch chứa các ion có khả năng dẫn điện.
- Quá trình chuyển hóa: Sự điện li của các chất dinh dưỡng trong cơ thể là cần thiết cho các quá trình chuyển hóa.
Các ứng dụng của sự điện li
Sự điện li được ứng dụng trong nhiều lĩnh vực, bao gồm:
- Sản xuất hóa chất: Điện li được sử dụng để sản xuất các hóa chất như axit, bazơ, muối và kim loại.
- Mạ điện: Điện li được sử dụng để mạ các kim loại lên bề mặt các vật thể khác.
- Pin và acquy: Điện li đóng vai trò quan trọng trong hoạt động của pin và acquy.
- Y học: Điện li được ứng dụng trong xét nghiệm nước tiểu, phân tích máu và điều trị các bệnh về điện giải.
Kết luận
Sự điện li là một quá trình quan trọng trong hóa học và sinh học. Nó tạo ra các ion, là thành phần cơ bản tham gia vào các phản ứng hóa học, dẫn điện, chuyển hóa và nhiều quá trình khác. Sự hiểu biết về sự điện li có ý nghĩa quan trọng trong nhiều lĩnh vực khoa học và ứng dụng thực tiễn.
Mọi thắc mắc quý khách hàng xin vui lòng gửi về số Hotline 1900.868644 hoặc địa chỉ email [email protected] để được giải đáp. Trân trọng!

















