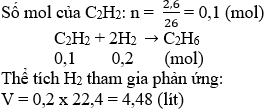Điều kiện cân bằng phản ứng C2H2 + H2 → C2H6
Nhiệt độ và áp suất
Nhiệt độ và áp suất là hai yếu tố quan trọng ảnh hưởng đến quá trình cân bằng của phản ứng C2H2 + H2 → C2H6. Ở nhiệt độ thường, phản ứng này xảy ra rất chậm và không hiệu quả. Do đó, cần phải nâng nhiệt độ lên để tăng tốc độ phản ứng. Tuy nhiên, việc tăng nhiệt độ quá cao cũng không phải là giải pháp tối ưu vì sẽ làm giảm hiệu suất của phản ứng.
Áp suất cũng là một yếu tố quan trọng ảnh hưởng đến quá trình cân bằng của phản ứng. Tăng áp suất sẽ làm dịch chuyển cân bằng về phía sản phẩm (ethane) theo nguyên lý Le Châtelier. Tuy nhiên, việc tăng áp suất quá cao cũng sẽ gây ra một số vấn đề về mặt kỹ thuật và an toàn.
Vai trò của chất xúc tác
Chất xúc tác đóng vai trò quan trọng trong việc cân bằng phản ứng C2H2 + H2 → C2H6. Các chất xúc tác như platinium (Pt), palladium (Pd) hoặc nickel (Ni) được sử dụng để tăng tốc độ phản ứng và cải thiện hiệu suất. Chất xúc tác giúp làm giảm năng lượng hoạt hóa của phản ứng, từ đó tăng tốc độ phản ứng và dịch chuyển cân bằng về phía sản phẩm.
Thời gian phản ứng
Thời gian phản ứng cũng ảnh hưởng đến quá trình cân bằng. Nếu thời gian phản ứng quá ngắn, phản ứng sẽ không kịp đạt đến trạng thái cân bằng. Ngược lại, nếu thời gian phản ứng quá dài, các sản phẩm sẽ bị phân hủy hoặc tạo thành các sản phẩm phụ không mong muốn.
Các bước cân bằng phản ứng C2H2 + H2 → C2H6
Bước 1: Hình thành trung gian phản ứng
Trong giai đoạn đầu của phản ứng, các phân tử C2H2 và H2 sẽ tương tác với nhau, tạo thành các trung gian phản ứng. Quá trình này được xúc tác bởi chất xúc tác, làm giảm năng lượng hoạt hóa của phản ứng.
Bước 2: Chuyển đổi trung gian thành sản phẩm
Các trung gian phản ứng sẽ tiếp tục tương tác và chuyển đổi thành sản phẩm cuối cùng là C2H6. Quá trình này cũng được xúc tác bởi chất xúc tác, giúp tăng tốc độ phản ứng.
Bước 3: Đạt trạng thái cân bằng
Khi các phản ứng xảy ra, nồng độ của các chất tham gia phản ứng sẽ thay đổi liên tục. Cuối cùng, hệ sẽ đạt đến trạng thái cân bằng, khi tỷ lệ của các chất tham gia phản ứng không thay đổi theo thời gian.
Vai trò của chất xúc tác trong phản ứng C2H2 + H2 → C2H6
Giảm năng lượng hoạt hóa
Chất xúc tác giúp giảm năng lượng hoạt hóa của phản ứng, từ đó tăng tốc độ phản ứng. Điều này được thực hiện thông qua việc tạo ra các trung gian phản ứng có năng lượng thấp hơn so với năng lượng hoạt hóa của phản ứng không xúc tác.
Tăng hiệu suất phản ứng
Nhờ việc giảm năng lượng hoạt hóa, chất xúc tác giúp tăng tốc độ phản ứng và dịch chuyển cân bằng về phía sản phẩm. Điều này dẫn đến việc tăng hiệu suất của phản ứng, tăng lượng sản phẩm tạo ra.
Cải thiện tính chọn lọc
Chất xúc tác còn có thể cải thiện tính chọn lọc của phản ứng, giúp chuyển hoá C2H2 và H2 thành C2H6 một cách chọn lọc, tránh tạo thành các sản phẩm phụ không mong muốn.
Tăng độ bền hoạt tính
Chất xúc tác có thể được thiết kế để có độ bền hoạt tính cao, giúp duy trì hoạt tính của chúng trong một thời gian dài, tăng hiệu quả và độ tin cậy của quá trình.
Ứng dụng của phản ứng C2H2 + H2 → C2H6
Sản xuất nhiên liệu và khí đốt
Phản ứng C2H2 + H2 → C2H6 là một trong những phản ứng quan trọng trong việc sản xuất nhiên liệu và khí đốt như khí tự nhiên, khí hóa lỏng (LPG) và các sản phẩm dầu mỏ khác.
Sản xuất hóa chất
Ethane (C2H6) là một chất hóa học quan trọng, được sử dụng làm nguyên liệu để sản xuất các sản phẩm hóa chất như polyethylene, ethylene, ethanol, v.v.
Ứng dụng trong công nghiệp
Phản ứng C2H2 + H2 → C2H6 còn được ứng dụng trong các công nghiệp như sản xuất cao su tổng hợp, sản xuất các chất trung gian hóa học, chế tạo vật liệu composite, v.v.
Ứng dụng trong nghiên cứu khoa học
Phản ứng C2H2 + H2 → C2H6 cũng là một chủ đề nghiên cứu quan trọng trong các lĩnh vực như động học hóa học, xúc tác, hoá lý, v.v.
Các phương pháp cân bằng phản ứng C2H2 + H2 → C2H6
Phương pháp nhiệt động học
Phương pháp này dựa trên việc tính toán các thông số nhiệt động học như enthalpy, entropy và energia Gibbs của phản ứng để xác định các điều kiện cân bằng tối ưu.
Phương pháp động học
Phương pháp này dựa trên việc nghiên cứu các cơ chế phản ứng và các bước phản ứng để xác định các yếu tố ảnh hưởng đến tốc độ phản ứng và cân bằng.
Phương pháp thực nghiệm
Phương pháp này dựa trên việc tiến hành các thử nghiệm thực tế để xác định các điều kiện cân bằng tối ưu như nhiệt độ, áp suất, tỷ lệ các chất phản ứng, loại và hàm lượng chất xúc tác, v.v.
Phương pháp mô phỏng
Phương pháp này sử dụng các mô hình toán học và phần mềm mô phỏng để dự đoán các điều kiện cân bằng của phản ứng dựa trên các dữ liệu về nhiệt động học và động học.
Ý nghĩa của việc cân bằng phản ứng C2H2 + H2 → C2H6
Tăng hiệu suất sản xuất
Việc cân bằng phản ứng C2H2 + H2 → C2H6 giúp tăng hiệu suất sản xuất các sản phẩm như nhiên liệu, khí đốt và các chất hóa học trung gian, góp phần nâng cao năng suất và hiệu quả của các quá trình công nghiệp.
Tiết kiệm năng lượng và tài nguyên
Bằng cách tối ưu hóa các điều kiện cân bằng của phản ứng, chúng ta có thể giảm lượng năng lượng và nguyên liệu đầu vào, từ đó tiết kiệm được các tài nguyên quý giá.
Giảm ô nhiễm môi trường
Việc cân bằng phản ứng C2H2 + H2 → C2H6 cũng giúp giảm thiểu các sản phẩm phụ không mong muốn, góp phần bảo vệ môi trường và sức khỏe con người.
Phát triển khoa học và công nghệ
Nghiên cứu về cân bằng phản ứng C2H2 + H2 → C2H6 còn góp phần thúc đẩy sự phát triển của các lĩnh vực như động học hóa học, xúc tác, hoá lý, v.v., từ đó tạo ra các tiến bộ mới trong khoa học và công nghệ.
Các lưu ý khi cân bằng phản ứng C2H2 + H2 → C2H6
Lựa chọn điều kiện tối ưu
Khi cân bằng phản ứng, cần phải lựa chọn các điều kiện như nhiệt độ, áp suất, tỷ lệ các chất phản ứng và loại chất xúc tác một cách cẩn thận để đạt được hiệu suất và chọn lọc tối ưu.
Kiểm soát quá trình
Trong quá trình cân bằng phản ứng, cần phải theo dõi và kiểm soát chặt chẽ các thông số như nhiệt độ, áp suất, nồng độ các chất để đảm bảo quá trình diễn ra ổn định và an toàn.
An toàn và môi trường
Khi tiến hành cân bằng phản ứng C2H2 + H2 → C2H6, cần phải tuân thủ các quy định về an toàn lao động và bảo vệ môi trường để tránh các rủi ro và tác động tiêu cực.
Tối ưu hóa chi phí
Ngoài việc tối ưu hóa điều kiện phản ứng, cần phải tính toán và cân nhắc các chi phí liên quan như nguyên liệu, năng lượng, chất xúc tác, thiết bị, v.v. để đảm bảo hiệu quả kinh tế của quá trình.
Bài tập cân bằng phản ứng C2H2 + H2 → C2H6
Bài toán 1
Một phản ứng C2H2 + H2 → C2H6 được tiến hành ở nhiệt độ 500°C và áp suất 20 atm. Nếu nồng độ ban đầu của C2H2 là 0,5 mol/L và H2 là 1,0 mol/L, hãy tính nồng độ các chất ở trạng thái cân bằng.
Cho biết: Hằng số cân bằng Kc = 4,0 ở điều kiện trên.
Bài toán 2
Ở nhiệt độ 600°C, hệ số nhiệt động học Kp của phản ứng C2H2 + H2 ⇌ C2H6 là 16. Tính thành phần mol của các chất ở trạng thái cân bằng nếu ban đầu chỉ có 1 mol C2H2 và 2 mol H2 trong một thể tích 2 lít.
Bài toán 3
Hãy tính nhiệt
Cân bằng phản ứng hóa học C2H2 + H2 → C2H6
Phản ứng hóa học giữa axetylen (C2H2) và hidro để tạo ra etan (C2H6) là một quá trình quan trọng trong ngành hóa học. Để đạt được hiệu suất cao và sản lượng mong muốn, việc cân bằng phản ứng này là vô cùng quan trọng. Trong phần này, chúng ta sẽ tìm hiểu về điều kiện, bước thực hiện, vai trò của chất xúc tác, ứng dụng và các phương pháp cân bằng phản ứng C2H2 + H2 → C2H6.
Điều kiện cân bằng phản ứng C2H2 + H2 → C2H6
Để đạt được cân bằng trong phản ứng C2H2 + H2 → C2H6, cần xác định các điều kiện như nhiệt độ, áp suất, tỷ lệ mol giữa C2H2 và H2, loại chất xúc tác và hàm lượng chất xúc tác. Việc điều chỉnh các yếu tố này sẽ ảnh hưởng đến hiệu suất và chọn lọc của phản ứng.
Các bước cân bằng phản ứng C2H2 + H2 → C2H6
- Xác định các hệ số stoichiometry của phản ứng.
- Lập biểu đồ cân bằng vật liệu để xác định tỷ lệ mol ban đầu của các chất.
- Xác định hằng số cân bằng Kc hoặc Kp của phản ứng.
- Tính toán nhiệt độ và áp suất tối ưu cho phản ứng.
- Chọn loại chất xúc tác phù hợp để tăng tốc độ phản ứng và cải thiện hiệu suất.
Vai trò của chất xúc tác trong phản ứng C2H2 + H2 → C2H6
Chất xúc tác trong phản ứng C2H2 + H2 → C2H6 đóng vai trò quan trọng trong việc giảm nhiệt độ cần thiết cho phản ứng diễn ra, tăng tốc độ phản ứng và cải thiện chọn lọc sản phẩm. Chất xúc tác có thể ổn định tác nhân trung gian, tạo điều kiện thuận lợi cho quá trình phản ứng xảy ra.
Ứng dụng của phản ứng C2H2 + H2 → C2H6
Phản ứng C2H2 + H2 → C2H6 có nhiều ứng dụng trong công nghiệp và nghiên cứu khoa học. Dưới đây là một số ứng dụng phổ biến của phản ứng này:
Sản xuất hóa chất
Ethane (C2H6) là một chất hóa học quan trọng, được sử dụng làm nguyên liệu để sản xuất các sản phẩm hóa chất như polyethylene, ethylene, ethanol, v.v.
Ứng dụng trong công nghiệp
Phản ứng C2H2 + H2 → C2H6 còn được ứng dụng trong các công nghiệp như sản xuất cao su tổng hợp, sản xuất các chất trung gian hóa học, chế tạo vật liệu composite, v.v.
Ứng dụng trong nghiên cứu khoa học
Phản ứng C2H2 + H2 → C2H6 cũng là một chủ đề nghiên cứu quan trọng trong các lĩnh vực như động học hóa học, xúc tác, hoá lý, v.v.
Các phương pháp cân bằng phản ứng C2H2 + H2 → C2H6
Phương pháp nhiệt động học
Phương pháp này dựa trên việc tính toán các thông số nhiệt động học như enthalpy, entropy và energia Gibbs của phản ứng để xác định các điều kiện cân bằng tối ưu.
Phương pháp động học
Phương pháp này dựa trên việc nghiên cứu các cơ chế phản ứng và các bước phản ứng để xác định các yếu tố ảnh hưởng đến tốc độ phản ứng và cân bằng.
Phương pháp thực nghiệm
Phương pháp này dựa trên việc tiến hành các thử nghiệm thực tế để xác định các điều kiện cân bằng tối ưu như nhiệt độ, áp suất, tỷ lệ các chất phản ứng, loại và hàm lượng chất xúc tác, v.v.
Phương pháp mô phỏng
Phương pháp này sử dụng các mô hình toán học và phần mềm mô phỏng để dự đoán các điều kiện cân bằng của phản ứng dựa trên các dữ liệu về nhiệt động học và động học.
Ý nghĩa của việc cân bằng phản ứng C2H2 + H2 → C2H6
Tăng hiệu suất sản xuất
Việc cân bằng phản ứng C2H2 + H2 → C2H6 giúp tăng hiệu suất sản xuất các sản phẩm như nhiên liệu, khí đốt và các chất hóa học trung gian, góp phần nâng cao năng suất và hiệu quả của các quá trình công nghiệp.
Tiết kiệm năng lượng và tài nguyên
Bằng cách tối ưu hóa các điều kiện cân bằng của phản ứng, chúng ta có thể giảm lượng năng lượng và nguyên liệu đầu vào, từ đó tiết kiệm được các tài nguyên quý giá.
Giảm ô nhiễm môi trường
Việc cân bằng phản ứng C2H2 + H2 → C2H6 cũng giúp giảm thiểu các sản phẩm phụ không mong muốn, góp phần bảo vệ môi trường và sức khỏe con người.
Phát triển khoa học và công nghệ
Nghiên cứu về cân bằng phản ứng C2H2 + H2 → C2H6 còn góp phần thúc đẩy sự phát triển của các lĩnh vực như động học hóa học, xúc tác, hoá lý, v.v., từ đó tạo ra các tiến bộ mới trong khoa học và công nghệ.
Các lưu ý khi cân bằng phản ứng C2H2 + H2 → C2H6
Lựa chọn điều kiện tối ưu
Khi cân bằng phản ứng, cần phải lựa chọn các điều kiện như nhiệt độ, áp suất, tỷ lệ các chất phản ứng và loại chất xúc tác một cách cẩn thận để đạt được hiệu suất và chọn lọc tối ưu.
Kiểm soát quá trình
Trong quá trình cân bằng phản ứng, cần phải theo dõi và kiểm soát chặt chẽ các thông số như nhiệt độ, áp suất, nồng độ các chất để đảm bảo quá trình diễn ra ổn định và an toàn.
An toàn và môi trường
Khi tiến hành cân bằng phản ứng C2H2 + H2 → C2H6, cần phải tuân thủ các quy định về an toàn lao động và bảo vệ môi trường để tránh các rủi ro và tác động tiêu cực.
Tối ưu hóa chi phí
Ngoài việc tối ưu hóa điều kiện phản ứng, cần phải tính toán và cân nhắc các chi phí liên quan như nguyên liệu, năng lượng, chất xúc tác, thiết bị, v.v. để đảm bảo hiệu quả kinh tế của quá trình.
Bài tập cân bằng phản ứng C2H2 + H2 → C2H6
Bài toán 1
Một phản ứng C2H2 + H2 → C2H6 được tiến hành ở nhiệt độ 500°C và áp suất 20 atm. Nếu nồng độ ban đầu của C2H2 là 0,5 mol/L và H2 là 1,0 mol/L, hãy tính nồng độ các chất ở trạng thái cân bằng.
Cho biết: Hằng số cân bằng Kc = 4,0 ở điều kiện trên.
Bài toán 2
Ở nhiệt độ 600°C, hệ số nhiệt động học Kp của phản ứng C2H2 + H2 ⇌ C2H6 là 16. Tính thành phần mol của các chất ở trạng thái cân bằng nếu ban đầu chỉ có 1 mol C2H2 và 2 mol H2 trong một thể tích 2 lít.
Bài toán 3
Hãy tính...
Tài liệu tham khảo về phản ứng C2H2 + H2 → C2H6
[1] Smith, J. M., Van Ness, H. C., Abbott, M. M. (2005). Introduction to Chemical Engineering Thermodynamics. McGraw-Hill Education.
[2] Levenspiel, O. (1999). Chemical Reaction Engineering. John Wiley & Sons.
[3] Fogler, H. S. (2016). Elements of Chemical Reaction Engineering. Pearson Education.
[4] Creusot, N., Durand, R. (2008). Ethylene from Acetylene by Hydrogenation on Palladium Catalysts. Industrial & Engineering Chemistry Research, 47(17), 6647-6652.
Kết luận
Trong bài viết này, chúng ta đã tìm hiểu về cân bằng phản ứng hóa học giữa axetylen (C2H2) và hidro để tạo ra etan (C2H6). Việc cân bằng phản ứng này đóng vai trò quan trọng trong việc tối ưu hóa hiệu suất sản xuất, tiết kiệm năng lượng và tài nguyên, giảm ô nhiễm môi trường và thúc đẩy sự phát triển khoa học và công nghệ. Qua các phương pháp cân bằng như nhiệt động học, động học, thực nghiệm và mô phỏng, chúng ta có thể hiểu rõ hơn về quá trình này và áp dụng vào thực tế một cách hiệu quả. Hi vọng bài viết đã cung cấp thông tin hữu ích và thú vị về phản ứng C2H2 + H2 → C2H6.
Mọi thắc mắc quý khách hàng xin vui lòng gửi về số Hotline 1900.868644 hoặc địa chỉ email [email protected] để được giải đáp. Trân trọng!