Phản ứng hóa học cần cân bằng
Phản ứng hóa học là quá trình trong đó các chất ban đầu (chất tham gia) biến đổi thành các chất mới (chất sản phẩm) thông qua quá trình trao đổi electron hoặc chia tách các liên kết hóa học. Để xác định chính xác sản phẩm của phản ứng, cũng như tỉ lệ tạo thành các sản phẩm, chúng ta cần cân bằng phản ứng hóa học.
Khái niệm cân bằng phản ứng hóa học
Cân bằng phản ứng hóa học là quá trình xác định chính xác số lượng các chất tham gia và chất sản phẩm trong một phản ứng hóa học, nhằm đảm bảo phản ứng diễn ra một cách cân bằng, hợp lý và tuân theo định luật bảo toàn chất. Việc cân bằng phản ứng giúp chúng ta hiểu rõ hơn về động lực học và nhinhiệt học của phản ứng, từ đó có thể điều chỉnh các điều kiện phản ứng để đạt được hiệu suất và sản lượng cao nhất.
Tầm quan trọng của cân bằng phản ứng hóa học
Cân bằng phản ứng hóa học là một khâu vô cùng quan trọng trong ngành hóa học, vì nó giúp:
- Xác định chính xác các chất tham gia và sản phẩm của phản ứng.
- Tính toán tỉ lệ các chất tham gia và sản phẩm trong phản ứng.
- Hiểu rõ về động lực học và nhiệt học của phản ứng.
- Điều chỉnh các điều kiện phản ứng (nhiệt độ, áp suất, nồng độ, ...) để tối ưu hóa hiệu suất và sản lượng.
- Ứng dụng phản ứng hóa học một cách hiệu quả trong công nghiệp, y học, kỹ thuật và các lĩnh vực khác.
Vì vậy, việc cân bằng phản ứng hóa học luôn được coi là một kỹ năng cơ bản và quan trọng đối với mọi nhà hóa học.
Chất tham gia phản ứng
Chất tham gia phản ứng, còn được gọi là chất phản ứng, là những chất được sử dụng làm nguyên liệu đầu vào của phản ứng hóa học. Trong phản ứng giữa CO2 và NaOH, các chất tham gia phản ứng là:
Carbon dioxide (CO2)
- CO2 là một khí không màu, không mùi, không cháy và không độc.
- Nguồn chính của CO2 là do sự hô hấp của sinh vật, sự đốt cháy nhiên liệu hóa thạch, quá trình lên men và các phản ứng hóa học khác.
- CO2 là một chất khí ổn định, nhưng có thể tham gia vào nhiều phản ứng hóa học khác nhau.
Natri hydroxide (NaOH)
- NaOH là một chất rắn tinh thể trắng, còn được gọi là natri hydroxit hoặc kiềm ăn.
- NaOH là một chất kiềm mạnh, có tính tẩy rửa và ăn mòn cao.
- NaOH thường được sử dụng trong các quá trình công nghiệp như sản xuất bột giặt, giấy, thuỷ tinh, xà phòng, sản xuất alumin, ...
Sự tương tác hóa học giữa CO2 và NaOH sẽ tạo ra các sản phẩm mới, đó chính là chất sản phẩm của phản ứng.
Chất sản phẩm phản ứng
Khi CO2 và NaOH tham gia phản ứng với nhau, các sản phẩm chính của phản ứng được tạo ra là:
Natri carbonate (Na2CO3)
- Na2CO3 là một chất rắn tinh thể, màu trắng, thường được gọi là natri cacbonat hoặc natri muối carbonic.
- Na2CO3 có nhiều ứng dụng quan trọng trong công nghiệp hóa chất, sản xuất thủy tinh, xà phòng, chất tẩy rửa, ...
- Na2CO3 là một chất kiềm yếu, có tính chất bazơ và thường được sử dụng để trung hòa axit.
Nước (H2O)
- Nước (H2O) là một chất lỏng không màu, không mùi, không độc, là một chất rất quan trọng cho sự sống và các quá trình công nghiệp.
- Trong phản ứng giữa CO2 và NaOH, nước được tạo ra như một sản phẩm phụ.
Quá trình tương tác hóa học giữa CO2 và NaOH để tạo ra Na2CO3 và H2O được mô tả bằng phương trình hóa học như sau:
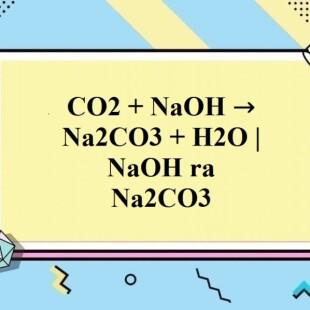
CO2 + 2NaOH → Na2CO3 + H2O
Đây là phương trình cân bằng hóa học cho phản ứng này, thể hiện đúng tỉ lệ các chất tham gia và sản phẩm.
Tỉ lệ cân bằng của phản ứng
Trong phản ứng hóa học giữa CO2 và NaOH, tỉ lệ cân bằng của các chất tham gia và sản phẩm là rất quan trọng. Tỉ lệ cân bằng phản ứng được xác định bằng các hệ số stoichiometric trong phương trình hóa học.
Tỉ lệ mol của các chất
Theo phương trình phản ứng: CO2 + 2NaOH → Na2CO3 + H2O, chúng ta có:
- 1 mol CO2 phản ứng với 2 mol NaOH
- 1 mol Na2CO3 được tạo ra
- 1 mol H2O được tạo ra
Vì vậy, tỉ lệ mol của các chất tham gia và sản phẩm là:
- 1 mol CO2 : 2 mol NaOH : 1 mol Na2CO3 : 1 mol H2O
Tỉ lệ khối lượng của các chất
Ngoài tỉ lệ mol, chúng ta cũng cần xác định tỉ lệ khối lượng của các chất tham gia và sản phẩm. Dựa trên khối lượng nguyên tử/phân tử của các chất, ta có:
- 44 g CO2 phản ứng với 80 g NaOH
- Tạo ra 106 g Na2CO3
- Tạo ra 18 g H2O
Vì vậy, tỉ lệ khối lượng của các chất là:
- 44 g CO2 : 80 g NaOH : 106 g Na2CO3 : 18 g H2O
Việc xác định chính xác tỉ lệ cân bằng của các chất là rất quan trọng, vì nó ảnh hưởng đến hiệu suất và sản lượng của phản ứng.
Phương pháp cân bằng phản ứng
Để cân bằng một phản ứng hóa học, chúng ta cần tuân thủ các bước sau:
Viết phương trình phản ứng không cân bằng
Trước tiên, chúng ta viết phương trình phản ứng với các chất tham gia và sản phẩm, nhưng chưa cân bằng số nguyên tử của các nguyên tố.
Ví dụ: CO2 + NaOH → Na2CO3 + H2O
Xác định hệ số cân bằng
Dựa trên phương trình phản ứng, chúng ta xác định hệ số cân bằng cho từng chất tham gia và sản phẩm sao cho tổng số nguyên tử của các nguyên tố trước và sau phản ứng là bằng nhau.
Ví dụ: CO2 + 2NaOH → Na2CO3 + H2O
Kiểm tra tính cân bằng
Sau khi cân bằng phương trình, chúng ta kiểm tra lại để đảm bảo rằng số nguyên tử của các nguyên tố trước và sau phản ứng là bằng nhau.
Ví dụ:
- Số nguyên tử C: 1 (trước) = 1 (sau)
- Số nguyên tử Na: 2 (trước) = 2 (sau)
- Số nguyên tử O: 3 (trước) = 3 (sau)
- Số nguyên tử H: 2 (trước) = 2 (sau)
Như vậy, phương trình đã được cân bằng đúng.
Kiểm tra tỉ lệ mol và khối lượng
Cuối cùng, chúng ta tính toán tỉ lệ mol và khối lượng của các chất tham gia và sản phẩm dựa trên hệ số cân bằng trong phương trình.
Qua các bước trên, chúng ta đã hoàn thành quá trình cân bằng phản ứng hóa học giữa CO2 và NaOH.
Ví dụ cân bằng phản ứng CO2 + NaOH → Na2CO3 + H2O
Để có một ví dụ cụ thể về cân bằng phản ứng, hãy cùng xem xét phản ứng giữa CO2 và NaOH tạo thành Na2CO3 và H2O.
Viết phương trình phản ứng không cân bằng
Phương trình phản ứng ban đầu là: CO2 + NaOH → Na2CO3 + H2O
Xác định hệ số cân bằng
Để cân bằng phương trình, chúng ta cần xác định hệ số cân bằng cho từng chất tham gia và sản phẩm như sau:
CO2 + 2NaOH → Na2CO3 + H2O
Kiểm tra tính cân bằng
Kiểm tra số nguyên tử của các nguyên tố trước và sau phản ứng:
- Số nguyên tử C: 1 (trước) = 1 (sau)
- Số nguyên tử Na: 2 (trước) = 2 (sau)
- Số nguyên tử O: 3 (trước) = 3 (sau)
- Số nguyên tử H: 2 (trước) = 2 (sau)
Như vậy, phương trình đã được cân bằng đúng.
Tính tỉ lệ mol và khối lượng
Từ phương trình cân bằng, chúng ta có:
- 1 mol CO2 phản ứng với 2 mol NaOH
- Tạo ra 1 mol Na2CO3 và 1 mol H2O
Về khối lượng:
- 44 g CO2 phản ứng với 80 g NaOH
- Tạo ra 106 g Na2CO3 và 18 g H2O
Vì vậy, tỉ lệ mol và khối lượng của các chất tham gia và sản phẩm là:
- 1 mol CO2 : 2 mol NaOH : 1 mol Na2CO3 : 1 mol H2O
- 44 g CO2 : 80 g NaOH : 106 g Na2CO3 : 18 g H2O
Như vậy, chúng ta đã hoàn thành quá trình cân bằng phản ứng hóa học giữa CO2 và NaOH.
Vai trò của nước trong phản ứng
Nước (H2O) là một sản phẩm phụ được tạo ra trong phản ứng giữa CO2 và NaOH. Tuy nhiên, vai trò của nước trong phản ứng này không thể bị忽视.
Tạo môi trường phản ứng thuận lợi
Sự hiện diện của nước trong phản ứng giúp tạo ra một môi trường phản ứng thuận lợi. Nước có khả năng hòa tan các chất, giúp cho việc tiếp xúc và phản ứng giữa CO2 và NaOH diễn ra dễ dàng hơn. Đồng thời, nước cũng giúp duy trì độ ẩm trong quá trình phản ứng, ngăn chặn sự bay hơi của các chất và đảm bảo hiệu suất của phản ứng.
Đóng vai trò làm dung môi
Nước cũng đóng vai trò làm dung môi trong quá trình phản ứng. Nó giúp cho các phân tử CO2 và NaOH tương tác với nhau, tạo thành sản phẩm Na2CO3 và H2O. Dung môi nước giúp cho các phân tử dễ dàng di chuyển và tương tác với nhau, từ đó tạo ra sản phẩm cuối cùng của phản ứng.
Vai trò của nước trong phản ứng giữa CO2 và NaOH không chỉ đơn giản là sản phẩm phụ mà còn là yếu tố quan trọng giúp cho quá trình phản ứng diễn ra hiệu quả.
Vai trò của NaOH trong phản ứng
NaOH (Natri hidroxit) là chất kiềm mạnh được sử dụng trong phản ứng hóa học với CO2 để tạo ra Na2CO3 và H2O. NaOH đóng vai trò quan trọng trong quá trình này.
Tính kiềm mạnh của NaOH
NaOH là một chất kiềm mạnh, có khả năng tương tác mạnh mẽ với axit như CO2. Trong quá trình phản ứng, NaOH tác động lên CO2, tạo ra muối natri cacbonat (Na2CO3) và nước (H2O). Sự tương tác giữa NaOH và CO2 là cơ sở của phản ứng hóa học này.
Xúc tác cho phản ứng
NaOH cũng có thể đóng vai trò xúc tác cho phản ứng giữa CO2 và NaOH diễn ra nhanh chóng và hiệu quả hơn. Việc sử dụng NaOH giúp giảm năng lượng cần thiết cho phản ứng và tăng tốc độ phản ứng, từ đó tạo ra sản phẩm mong muốn một cách hiệu quả.
Đóng vai trò điều chỉnh pH
Ngoài ra, NaOH còn đóng vai trò điều chỉnh pH trong quá trình phản ứng. Do là một chất kiềm mạnh, NaOH có khả năng điều chỉnh và duy trì độ pH của môi trường phản ứng, giúp cho phản ứng diễn ra ổn định và hiệu quả.
Với những vai trò quan trọng như vậy, NaOH đóng vai trò không thể thiếu trong phản ứng hóa học giữa CO2 và NaOH để tạo ra Na2CO3 và H2O.
Ứng dụng của phản ứng hóa học này trong thực tiễn
Phản ứng hóa học giữa CO2 và NaOH để tạo ra Na2CO3 và H2O có nhiều ứng dụng trong thực tiễn, đặc biệt trong lĩnh vực công nghiệp và môi trường.
Sử dụng trong sản xuất xà phòng
Na2CO3 là một thành phần quan trọng trong việc sản xuất xà phòng. Phản ứng giữa CO2 và NaOH tạo ra Na2CO3, sau đó có thể được sử dụng để sản xuất xà phòng thông qua các quy trình hóa học khác. Việc sử dụng phản ứng này giúp tạo ra nguồn nguyên liệu chất lượng cao cho ngành sản xuất xà phòng.
Ứng dụng trong xử lý nước thải
Phản ứng giữa CO2 và NaOH cũng có thể được áp dụng trong việc xử lý nước thải. NaOH có khả năng tạo ra môi trường kiềm, giúp tẩy rửa và loại bỏ các chất ô nhiễm trong nước thải. Đồng thời, Na2CO3 cũng có thể hấp thụ CO2 trong nước thải, giúp làm giảm lượng khí CO2 gây ô nhiễm môi trường.
Sử dụng trong sản xuất hóa chất
Na2CO3 được tạo ra từ phản ứng giữa CO2 và NaOH cũng là nguyên liệu quan trọng trong việc sản xuất hóa chất khác như muối, thuốc nhuộm, thuốc trừ sâu, vv. Việc sử dụng phản ứng này giúp tạo ra nguồn nguyên liệu hóa chất đa dạng và phong phú cho công nghiệp hóa chất.
Với những ứng dụng đa dạng và quan trọng như vậy, phản ứng hóa học giữa CO2 và NaOH để tạo ra Na2CO3 và H2O đóng vai trò quan trọng trong nhiều lĩnh vực khác nhau trong thực tiễn.
Lưu ý khi cân bằng phản ứng hóa học
Khi cân bằng phản ứng hóa học, có một số lưu ý quan trọng mà chúng ta cần nhớ để đảm bảo quá trình cân bằng diễn ra chính xác và hiệu quả.
Kiểm tra lại phương trình cân bằng
Sau khi đã cân bằng phương trình, chúng ta cần kiểm tra lại để đảm bảo rằng số nguyên tử của các nguyên tố trước và sau phản ứng là bằng nhau. Việc này giúp đảm bảo tính chính xác của phương trình và kết quả của phản ứng.
Xác định đúng hệ số cân bằng
Việc xác định đúng hệ số cân bằng cho từng chất tham gia và sản phẩm là rất quan trọng. Sai sót trong việc xác định hệ số có thể dẫn đến kết quả không chính xác của phản ứng và ảnh hưởng đến hiệu suất của quá trình.
Tính toán tỉ lệ mol và khối lượng chính xác
Cuối cùng, chúng ta cần tính toán tỉ lệ mol và khối lượng của các chất tham gia và sản phẩm một cách chính xác dựa trên hệ số cân bằng trong phương trình. Việc này giúp đảm bảo rằng quá trình phản ứng diễn ra đúng và hiệu quả.
Với những lưu ý trên, chúng ta có thể cân bằng phản ứng hóa học một cách chính xác và hiệu quả, đảm bảo kết quả của phản ứng đạt được mong đợi.
Kết luận
Trong bài viết này, chúng ta đã tìm hiểu về phản ứng hóa học giữa CO2 và NaOH để tạo ra Na2CO3 và H2O. Chúng ta đã cần bằng phản ứng này bằng cách xác định tỉ lệ cân bằng của các chất tham gia và sản phẩm, áp dụng phương pháp cân bằng phản ứng và thấy được vai trò của nước và NaOH trong quá trình này. Chúng ta cũng đã thấy ứng dụng của phản ứng này trong thực tiễn và những lưu ý khi cân bằng phản ứng hóa học. Hi vọng bài viết mang lại cho bạn cái nhìn tổng quan và chi tiết về quá trình cân bằng phản ứng hóa học này.
Mọi thắc mắc quý khách hàng xin vui lòng gửi về số Hotline 1900.868644 hoặc địa chỉ email [email protected] để được giải đáp. Trân trọng!