PHÂN TÍCH SẢN PHẨM PHẢN ỨNG
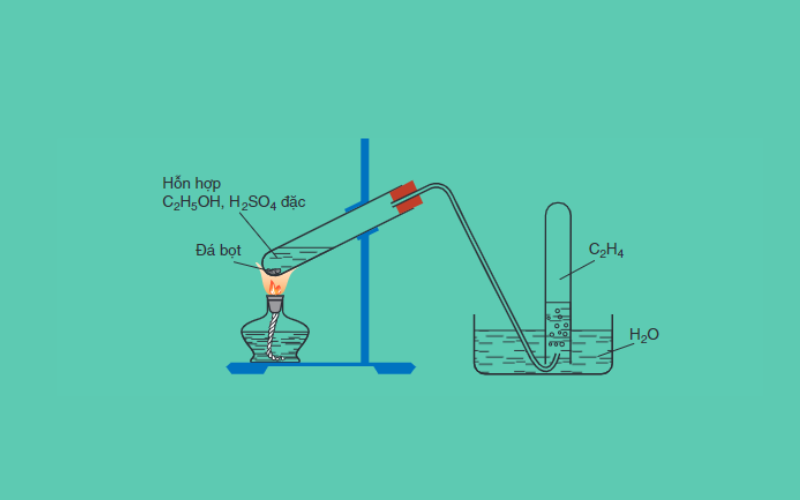
Phản ứng phân hủy C2H5OH thành C2H4 và H2O có thể được biểu diễn như sau:
C2H5OH → C2H4 + H2O
Trong phản ứng này, ethanol (C2H5OH) là chất phản ứng, còn ethylene (C2H4) và nước (H2O) là sản phẩm của phản ứng. Để hiểu rõ hơn về quá trình này, chúng ta cần phân tích từng sản phẩm:
- Ethylene (C2H4): Ethylene là một khí vô màu, dễ cháy, có mùi dịu. Nó là một sản phẩm quan trọng trong công nghiệp hoá học, được sử dụng làm nguyên liệu để sản xuất nhiều loại hợp chất hữu cơ khác, như polyethylene, vinyl chloride, ethanol, v.v.
- Nước (H2O): Nước là một chất lỏng không màu, vô vị, vô mùi. Nó là một trong những chất quan trọng nhất trên Trái Đất, đóng vai trò thiết yếu trong nhiều quá trình sinh học, hoá học và vật lý.
Việc phân tích các sản phẩm của phản ứng giúp chúng ta hiểu rõ hơn về bản chất của phản ứng và những ứng dụng tiềm năng của nó.
XÁC ĐỊNH SỐ MOL CỦA CÁC CHẤT
Để cân bằng phản ứng, chúng ta cần xác định số mol của các chất tham gia phản ứng. Giả sử ban đầu chúng ta có n0 mol C2H5OH, và sau khi phản ứng xảy ra, số mol của các chất thay đổi như sau:
- C2H5OH: n0 - x mol
- C2H4: x mol
- H2O: x mol
Trong đó, x là số mol của C2H4 và H2O tạo thành.
TÌM HỆ SỐ CÂN BẰNG
Để tìm hệ số cân bằng, chúng ta sử dụng phương trình cân bằng:
C2H5OH ⇌ C2H4 + H2O
Ở trạng thái cân bằng, tỉ lệ giữa nồng độ các chất tham gia phản ứng được xác định bởi hằng số cân bằng Kc:
Kc = [C2H4] × [H2O] / [C2H5OH]
Trong đó, [C2H4], [H2O], [C2H5OH] lần lượt là nồng độ của C2H4, H2O và C2H5OH tại trạng thái cân bằng.
Bằng cách sử dụng số mol của các chất ở trạng thái cân bằng, chúng ta có thể tính được hằng số cân bằng Kc như sau:
Kc = (x × x) / (n0 - x)
Từ phương trình này, chúng ta có thể giải để tìm được x, tức là số mol của C2H4 và H2O tạo thành.
KIỂM TRA ĐỘ CÂN BẰNG
Sau khi tìm được x, chúng ta có thể kiểm tra độ cân bằng của phản ứng bằng cách so sánh tỉ lệ giữa các chất tại trạng thái cân bằng với hằng số cân bằng Kc.
Nếu tỉ lệ giữa các chất tại trạng thái cân bằng bằng Kc, có nghĩa là phản ứng đã đạt đến trạng thái cân bằng. Nếu tỉ lệ khác Kc, chứng tỏ phản ứng chưa đạt đến trạng thái cân bằng.
NGUYÊN TẮC CÂN BẰNG PHẢN ỨNG
Các nguyên tắc cân bằng phản ứng bao gồm:
- Nguyên tắc Le Chatelier: Khi một hệ cân bằng bị tác động bởi một yếu tố bên ngoài (như thay đổi nồng độ, áp suất, nhiệt độ), hệ sẽ tự động điều chỉnh để giảm thiểu tác động đó và lại đạt đến trạng thái cân bằng mới.
- Ảnh hưởng của nhiệt độ: Tăng nhiệt độ sẽ làm dịch chuyển cân bằng theo chiều thuận của phản ứng吸热, giảm nhiệt độ sẽ làm dịch chuyển cân bằng theo chiều nghịch của phản ứng放热.
- Ảnh hưởng của áp suất: Tăng áp suất sẽ làm dịch chuyển cân bằng theo chiều của phản ứng có số mol khí ít hơn, giảm áp suất sẽ làm dịch chuyển cân bằng theo chiều của phản ứng có số mol khí nhiều hơn.
- Ảnh hưởng của nồng độ: Tăng nồng độ của một chất tham gia phản ứng sẽ làm dịch chuyển cân bằng theo chiều thuận của phản ứng, tăng nồng độ của một chất sản phẩm sẽ làm dịch chuyển cân bằng theo chiều nghịch của phản ứng.
Việc hiểu rõ các nguyên tắc này sẽ giúp chúng ta dự đoán và kiểm soát quá trình cân bằng phản ứng một cách hiệu quả.
ỨNG DỤNG CÂN BẰNG PHẢN ỨNG
Cân bằng phản ứng có nhiều ứng dụng quan trọng trong công nghiệp và khoa học, bao gồm:
- Sản xuất hóa chất: Trong các quá trình sản xuất hóa chất, việc hiểu và kiểm soát cân bằng phản ứng là rất quan trọng để tối ưu hóa năng suất và chi phí.
- Công nghiệp luyện kim: Các phản ứng cân bằng đóng vai trò quan trọng trong các quá trình luyện kim như sản xuất thép, sản xuất nhôm, v.v.
- Công nghiệp dầu khí: Các phản ứng cân bằng ảnh hưởng đến nhiều quá trình trong công nghiệp dầu khí, chẳng hạn như cracking, reforming, isomerization.
- Sinh học và y học: Nhiều quá trình sinh học và y học liên quan đến các phản ứng cân bằng, ví dụ như sự cân bằng axit-base trong cơ thể, sự cân bằng nước-điện giải, v.v.
- Môi trường: Các phản ứng cân bằng hóa học ảnh hưởng đến nhiều quá trình trong môi trường, chẳng hạn như sự cân bằng axit-base trong nước, sự cân bằng cacbon trong khí quyển, v.v.
Hiểu biết về cân bằng phản ứng giúp chúng ta kiểm soát và tối ưu hóa các quá trình trong nhiều lĩnh vực khoa học và công nghệ.
BÀI TOÁN VÍ DỤ VỀ CÂN BẰNG PHẢN ỨNG
Ví dụ: Cho phản ứng cân bằng sau: C2H5OH ⇌ C2H4 + H2O
Biết rằng ở 450°C, hằng số cân bằng Kc = 4,2. Nếu ban đầu có 10 mol C2H5OH, hãy tính số mol của các chất tại trạng thái cân bằng.
Giải: Gọi số mol C2H4 và H2O tại trạng thái cân bằng là x mol. Số mol C2H5OH tại trạng thái cân bằng là 10 - x mol.
Theo định nghĩa hằng số cân bằng Kc: Kc = [C2H4] × [H2O] / [C2H5OH] Kc = (x × x) / (10 - x) 4,2 = (x × x) / (10 - x) 42 = x^2 / (10 - x) x^2 + 42x - 420 = 0
Giải phương trình bậc 2 trên, ta được: x = 4 mol
Vậy số mol của các chất tại trạng thái cân bằng là:
- C2H5OH: 10 - 4 = 6 mol
- C2H4: 4 mol
- H2O: 4 mol
PHƯƠNG PHÁP CÂN BẰNG PHẢN ỨNG
Để cân bằng một phản ứng, chúng ta có thể áp dụng các bước sau:
- Viết phương trình phản ứng cân bằng: Xác định các chất tham gia phản ứng và viết phương trình phản ứng cân bằng.
- Xác định số mol ban đầu: Xác định số mol ban đầu của các chất tham gia phản ứng.
- Tìm hằng số cân bằng: Tính hằng số cân bằng Kc dựa trên nồng độ hoặc số mol của các chất tại trạng thái cân bằng.
- Thiết lập phương trình cân bằng: Thiết lập phương trình cân bằng để tính toán số mol của các chất tại trạng thái cân bằng.
- Kiểm tra độ cân bằng: So sánh tỉ lệ giữa các chất tại trạng thái cân bằng với hằng số cân bằng Kc để kiểm tra xem phản ứng đã đạt đến trạng thái cân bằng hay chưa.
- Ứng dụng nguyên tắc cân bằng: Áp dụng các nguyên tắc cân bằng phản ứng như nguyên tắc Le Chatelier để dự đoán ảnh hưởng của các yếu tố như nhiệt độ, áp suất, nồng độ đến quá trình cân bằng.
Bằng cách áp dụng các bước này, chúng ta có thể hiểu và kiểm soát tốt hơn các phản ứng cân bằng trong hoá học.
LƯU Ý KHI CÂN BẰNG PHẢN ỨNG
Khi cân bằng phản ứng, cần lưu ý một số điểm sau:
- Tính chất của các chất tham gia: Cần hiểu rõ tính chất của các chất tham gia phản ứng, bao gồm trạng thái, tính chất hoá học, v.v. để dự đoán và kiểm soát quá trình cân bằng.
- Ảnh hưởng của yếu tố bên ngoài: Cần nắm vững nguyên tắc Le Chatelier để dự đoán ảnh hưởng của các yếu tố như nhiệt độ, áp suất, nồng độ đến quá trình cân bằng.
- Tính toán chính xác: Việc tính toán số mol, nồng độ, hằng số cân bằng phải chính xác, vì các sai số nhỏ cũng có thể ảnh hưởng đáng kể đến kết quả.
- Trạng thái cân bằng: Cân bằng phản ứng không phải là tĩnh mà là động, các chất liên tục chuyển đổi qua lại giữa trạng thái phản ứng và trạng thái sản phẩm.
- Ứng dụng thực tế: Hiểu biết về cân bằng phản ứng rất quan trọng trong nhiều lĩnh vực thực tiễn như hoá học công nghiệp, môi trường, y học, v.
CÂN BẰNG PHẢN ỨNG SAU: C2H5OH --> C2H4 + H2O
Trong hoá học, cân bằng phản ứng là một khái niệm quan trọng để hiểu và dự đoán các quá trình hóa học. Trạng thái cân bằng của một phản ứng xảy ra khi tỉ lệ giữa các chất tham gia và sản phẩm duy trì ổn định sau khi đạt đến một quá trình cân bằng. Để hiểu rõ hơn về cân bằng phản ứng, chúng ta cần phân tích sâu hơn về sản phẩm của phản ứng, xác định số mol của các chất, tìm hiểu về hệ số cân bằng và áp dụng nguyên lý cân bằng vào thực tế.
PHÂN TÍCH SẢN PHẨM PHẢN ỨNG
Trong phản ứng được mô tả, Ethanol (C2H5OH) chuyển hóa thành Ethylene (C2H4) và nước (H2O). Quá trình này diễn ra theo phương trình:
C2H5OH → C2H4 + H2O
Sản phẩm của phản ứng bao gồm Ethylene và nước, với tỷ lệ số mol phụ thuộc vào điều kiện cụ thể của phản ứng. Để xác định hơn về cân bằng phản ứng này, chúng ta cần biết về các thông số từ phản ứng hoá học cơ bản.
XÁC ĐỊNH SỐ MOL CỦA CÁC CHẤT
Để tính toán và kiểm soát quá trình cân bằng phản ứng, việc xác định số mol của các chất tham gia và sản phẩm là cực kỳ quan trọng. Dựa vào phương trình phản ứng và hằng số cân bằng, chúng ta có thể suy ra tỉ lệ số mol của các chất.
Sử dụng ví dụ trên, nếu ban đầu có 10 mol C2H5OH và biết hằng số cân bằng Kc = 4,2, chúng ta có thể tính số mol của Ethylene và nước tại trạng thái cân bằng.
TÌM HỆ SỐ CÂN BẰNG
Hệ số cân bằng trong một phản ứng hóa học là chỉ số cho biết mức độ của sự cân bằng giữa các chất tham gia và sản phẩm trong phản ứng. Hệ số cân bằng được ước lượng dựa trên hằng số cân bằng và số mol của các chất tại trạng thái cân bằng.
Ví dụ: Trong phản ứng C2H5OH → C2H4 + H2O, hệ số cân bằng sẽ được tính toán dựa trên số mol của các chất tại trạng thái cân bằng và hằng số cân bằng Kc.
| Chất | Số mol tại trạng thái cân bằng |
|---|---|
| C2H5OH | 6 mol |
| C2H4 | 4 mol |
| H2O | 4 mol |
KIỂM TRA ĐỘ CÂN BẰNG
Sau khi xác định số mol của các chất tại trạng thái cân bằng, chúng ta có thể kiểm tra độ cân bằng của phản ứng bằng cách so sánh tỉ lệ giữa các sản phẩm và chất tham gia với hằng số cân bằng. Nếu tỉ lệ này khớp với giá trị của hằng số cân bằng, có thể kết luận rằng phản ứng đã đạt đến trạng thái cân bằng.
Việc kiểm tra độ cân bằng là cần thiết để đảm bảo tính chính xác và đáng tin cậy của quá trình phản ứng.
Vietnamese language
NGUYÊN TẮC CÂN BẰNG PHẢN ỨNG
Nguyên tắc cân bằng phản ứng là một khái niệm quan trọng trong hoá học định lượng. Các nguyên tắc này định nghĩa sự ổn định của trạng thái cân bằng trong một hệ thống hóa học và mối quan hệ giữa hằng số cân bằng, nhiệt độ, áp suất và số mol của các chất trong phản ứng.
Khi một phản ứng hóa học đạt đến trạng thái cân bằng, tỉ lệ giữa các chất tham gia và sản phẩm không thay đổi theo thời gian. Điều này là do tại trạng thái cân bằng, tổng năng lượng của hệ thống là tối thiểu.
ỨNG DỤNG CÂN BẰNG PHẢN ỨNG
Cân bằng phản ứng có nhiều ứng dụng quan trọng trong công nghiệp và khoa học, bao gồm:
- Sản xuất hóa chất: Trong các quá trình sản xuất hóa chất, việc hiểu và kiểm soát cân bằng phản ứng là rất quan trọng để tối ưu hóa năng suất và chi phí.
- Công nghiệp luyện kim: Các phản ứng cân bằng đóng vai trò quan trọng trong các quá trình luyện kim như sản xuất thép, sản xuất nhôm, v.v.
- Công nghiệp dầu khí: Các phản ứng cân bằng ảnh hưởng đến nhiều quá trình trong công nghiệp dầu khí, chẳng hạn như cracking, reforming, isomerization.
- Sinh học và y học: Nhiều quá trình sinh học và y học liên quan đến các phản ứng cân bằng, ví dụ như sự cân bằng axit-base trong cơ thể, sự cân bằng nước-điện giải, v.v.
- Môi trường: Các phản ứng cân bằng hóa học ảnh hưởng đến nhiều quá trình trong môi trường, chẳng hạn như sự cân bằng axit-base trong nước, sự cân bằng cacbon trong khí quyển, v.v.
Hiểu biết về cân bằng phản ứng giúp chúng ta kiểm soát và tối ưu hóa các quá trình trong nhiều lĩnh vực khoa học và công nghệ.
BÀI TOÁN VÍ DỤ VỀ CÂN BẰNG PHẢN ỨNG
Ví dụ: Cho phản ứng cân bằng sau: C2H5OH ⇌ C2H4 + H2O
Biết rằng ở 450°C, hằng số cân bằng Kc = 4,2. Nếu ban đầu có 10 mol C2H5OH, hãy tính số mol của các chất tại trạng thái cân bằng.
Giải: Gọi số mol C2H4 và H2O tại trạng thái cân bằng là x mol. Số mol C2H5OH tại trạng thái cân bằng là 10 - x mol.
Theo định nghĩa hằng số cân bằng Kc: Kc = [C2H4] × [H2O] / [C2H5OH] Kc = (x × x) / (10 - x) 4,2 = (x × x) / (10 - x) 42 = x^2 / (10 - x) x^2 + 42x - 420 = 0
Giải phương trình bậc 2 trên, ta được: x = 4 mol
Vậy số mol của các chất tại trạng thái cân bằng là:
- C2H5OH: 10 - 4 = 6 mol
- C2H4: 4 mol
- H2O: 4 mol
PHƯƠNG PHÁP CÂN BẰNG PHẢN ỨNG
Để cân bằng một phản ứng, chúng ta có thể áp dụng các bước sau:
- Viết phương trình phản ứng cân bằng: Xác định các chất tham gia phản ứng và viết phương trình phản ứng cân bằng.
- Xác định số mol ban đầu: Xác định số mol ban đầu của các chất tham gia phản ứng.
- Tìm hằng số cân bằng: Tính hằng số cân bằng Kc dựa trên nồng độ hoặc số mol của các chất tại trạng thái cân bằng.
- Thiết lập phương trình cân bằng: Thiết lập phương trình cân bằng để tính toán số mol của các chất tại trạng thái cân bằng.
- Kiểm tra độ cân bằng: So sánh tỉ lệ giữa các chất tại trạng thái cân bằng với hằng số cân bằng Kc để kiểm tra xem phản ứng đã đạt đến trạng thái cân bằng hay chưa.
- Ứng dụng nguyên tắc cân bằng: Áp dụng các nguyên tắc cân bằng phản ứng như nguyên tắc Le Chatelier để dự đoán ảnh hưởng của các yếu tố như nhiệt độ, áp suất, nồng độ đến quá trình cân bằng.
Bằng cách áp dụng các bước này, chúng ta có thể hiểu và kiểm soát tốt hơn các phản ứng cân bằng trong hoá học.
LƯU Ý KHI CÂN BẰNG PHẢN ỨNG
Khi cân bằng phản ứng, cần lưu ý một số điểm sau:
- Tính chất của các chất tham gia: Cần hiểu rõ tính chất của các chất tham gia phản ứng, bao gồm trạng thái, tính chất hoá học, v.v. để dự đoán và kiểm soát quá trình cân bằng.
- Ảnh hưởng của yếu tố bên ngoài: Cần nắm vững nguyên tắc Le Chatelier để dự đoán ảnh hưởng của các yếu tố như nhiệt độ, áp suất, nồng độ đến quá trình cân bằng.
- Tính toán chính xác: Việc tính toán số mol, nồng độ, hằng số cân bằng phải chính xác, vì các sai số nhỏ cũng có thể ảnh hưởng đáng kể đến kết quả.
- Trạng thái cân bằng: Cân bằng phản ứng không phải là tĩnh mà là động, các chất liên tục chuyển đổi qua lại giữa trạng thái phản ứng và trạng thái sản phẩm.
- Ứng dụng thực tế: Hiểu biết về cân bằng phản ứng rất quan trọng trong nhiều lĩnh vực thực tiễn như hoá chất công nghiệp, môi trường, y học, v.
Kết luận
Trong hoá học, cân bằng phản ứng là một khái niệm cơ bản nhưng quan trọng. Việc hiểu và áp dụng nguyên tắc cân bằng phản ứng giúp chúng ta dự đoán và kiểm soát các quá trình hóa học một cách hiệu quả. Qua việc phân tích sản phẩm phản ứng, xác định số mol, tìm hệ số cân bằng, kiểm tra độ cân bằng và nhớ lưu ý khi cân bằng phản ứng, chúng ta có thể áp dụng kiến thức này vào thực tế và nghiên cứu trong nhiều lĩnh vực.
Mọi thắc mắc quý khách hàng xin vui lòng gửi về số Hotline 1900.868644 hoặc địa chỉ email [email protected] để được giải đáp. Trân trọng!

















