Cách cân bằng phương trình Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
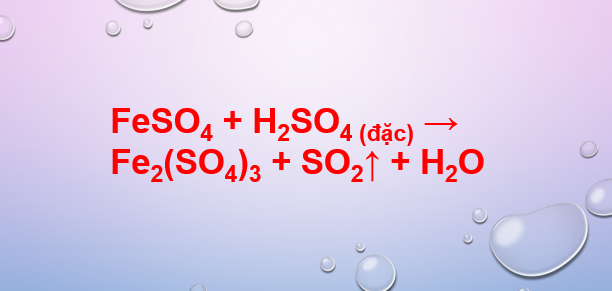
Bước 1: Xác định số nguyên tử của từng nguyên tố trên cả hai bên của phương trình
Để cân bằng phương trình hóa học Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O, ta cần xác định số nguyên tử của từng nguyên tố trên cả hai bên của phương trình. Trong trường hợp này, chúng ta có:
- Sắt (Fe): 1 nguyên tử ở bên trái và 2 nguyên tử ở bên phải
- Lưu huỳnh (S): 1 nguyên tử ở bên phải và 3 nguyên tử ở bên phải
- Oxy (O): 4 nguyên tử ở bên phải và 3 nguyên tử ở bên phải
- Hiđro (H): 2 nguyên tử ở bên phải và 2 nguyên tử ở bên phải
Bước 2: Cân bằng số nguyên tử của từng nguyên tố bằng cách điều chỉnh hệ số trước các chất
Sau khi đã xác định số nguyên tử của từng nguyên tố trên cả hai bên của phương trình, chúng ta cần cân bằng chúng bằng cách điều chỉnh hệ số trước các chất. Trên cơ sở số nguyên tử đã xác định ở bước trước, ta có thể thay đổi hệ số để cân bằng phương trình.
Bước 3: Kiểm tra lại phương trình sau khi cân bằng
Sau khi đã điều chỉnh hệ số trước các chất để cân bằng phương trình, chúng ta cần kiểm tra lại phương trình để đảm bảo rằng số nguyên tử của từng nguyên tố trên cả hai bên đã được cân bằng đúng.
Những lưu ý khi cân bằng phương trình Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Khi cân bằng phương trình hóa học Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O, có một số lưu ý quan trọng mà bạn cần nhớ:
- Không thay đổi công thức hóa học của các chất: Trong quá trình cân bằng phương trình, bạn chỉ nên điều chỉnh hệ số trước các chất mà không thay đổi công thức hóa học của chúng.
- Cân bằng từng nguyên tố một: Để đảm bảo tính chính xác khi cân bằng phương trình, bạn nên cân bằng từng nguyên tố một, bắt đầu từ nguyên tố xuất hiện ít nhất trong phương trình.
- Kiểm tra lại kết quả: Sau khi cân bằng phương trình, hãy kiểm tra lại kết quả để đảm bảo rằng số nguyên tử của từng nguyên tố trên cả hai bên đã được cân bằng đúng.
Ứng dụng của phản ứng Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Phản ứng hóa học Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O có nhiều ứng dụng trong thực tế, bao gồm:
- Sản xuất axit sunfuric: Phản ứng giữa sắt và axit sunfuric là một trong những phản ứng cơ bản để sản xuất axit sunfuric, một hợp chất hóa học quan trọng được sử dụng trong nhiều ngành công nghiệp.
- Quá trình oxi hóa khử: Phản ứng cũng thể hiện quá trình oxi hóa khử, giúp chúng ta hiểu rõ hơn về cơ chế phản ứng hóa học trong tự nhiên.
- Ứng dụng trong phân tích hóa học: Phản ứng Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O cũng được sử dụng trong phân tích hóa học để xác định hàm lượng các chất trong mẫu.
Bài tập cân bằng phương trình Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Bài tập 1: Cân bằng phương trình hóa học Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O.
Bài tập 2: Xác định hệ số trước các chất trong phản ứng Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O.
Bài tập 3: Kiểm tra kết quả sau khi cân bằng phương trình Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O.
| Bài tập | Kết quả |
|---|---|
| 1 | |
| 2 | |
| 3 |
Phản ứng oxi hóa khử Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Trong phản ứng Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O, sắt (Fe) bị oxi hóa từ hình thể sắt (Fe) sang ion sắt(III) (Fe3+), trong khi lưu huỳnh (S) trong axit sunfuric bị khử từ trạng thái oxi hóa +6 về trạng thái oxi hóa +4. Đây là một ví dụ minh họa cho quá trình oxi hóa khử trong hóa học.
Vai trò của Fe trong phản ứng Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Sắt (Fe) trong phản ứng Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O đóng vai trò quan trọng trong quá trình oxi hóa khử. Sắt bị oxi hóa từ trạng thái oxi hóa 0 sang trạng thái oxi hóa +3, tạo ra ion sắt(III) (Fe3+). Quá trình này giúp tạo ra sản phẩm cuối cùng của phản ứng là Fe2(SO4)3.
Ý nghĩa của phản ứng Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Phản ứng hóa học Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O có ý nghĩa quan trọng trong lĩnh vực hóa học và các ngành công nghiệp. Việc hiểu rõ về cơ chế phản ứng, ứng dụng và tầm quan trọng của phản ứng này giúp chúng ta áp dụng vào thực tiễn một cách hiệu quả.
Tầm quan trọng của việc cân bằng phương trình Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Việc cân bằng phương trình hóa học Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O là một bước quan trọng giúp chúng ta hiểu rõ hơn về quá trình phản ứng hóa học, cũng như áp dụng kiến thức vào thực tế. Quá trình cân bằng phương trình giúp chúng ta xác định hệ số cần thiết để cân bằng số nguyên tử của từng nguyên tố trên cả hai bên của phản ứng.
Kết luận
Trong bài viết này, chúng ta đã tìm hiểu về cách cân bằng phương trình hóa học Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O, các bước thực hiện, những lưu ý cần nhớ, ứng dụng của phản ứng, bài tập liên quan, vai trò của Fe trong phản ứng, ý nghĩa và tầm quan trọng của việc cân bằng phương trình này. Hi vọng rằng thông qua bài viết này, bạn đã có cái nhìn tổng quan về phản ứng hóa học này và áp dụng kiến thức vào thực tế một cách hiệu quả.
Mọi thắc mắc quý khách hàng xin vui lòng gửi về số Hotline 1900.868644 hoặc địa chỉ email [email protected] để được giải đáp. Trân trọng!

















