Hydroxinitrat Đồng(II) dihydrat
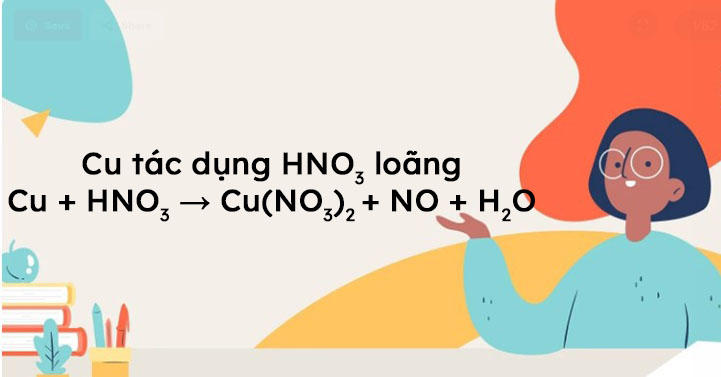
Hydroxinitrat đồng(II) dihydrat (Cu(NO3)2.2H2O) là một muối của đồng và axit nitơric. Nó có thể được điều chế thông qua phản ứng giữa đồng kim loại và axit nitơric hoặc bằng cách trộn kẽm nitơrat với dung dịch đồng sulfat. Kết quả thu được là một chất rắn màu xanh lá cây, tan trong nước và không tan trong các dung môi hữu cơ.
Phản ứng điều chế Cu(NO3)2.2H2O
Có hai cách để điều chế Cu(NO3)2.2H2O, đó là phản ứng giữa đồng kim loại và axit nitơric hoặc bằng cách trộn kẽm nitơrat với dung dịch đồng sulfat.
Phản ứng giữa đồng kim loại và axit nitơric
Phản ứng này xảy ra khi đồng kim loại được đưa vào axit nitơric đậm đặc. Kết quả thu được là một dung dịch màu xanh lá cây do sự hòa tan của đồng trong axit nitơric. Sau đó, dung dịch này được đun nóng để loại bỏ nước và tạo thành Cu(NO3)2.2H2O rắn.
Trộn kẽm nitơrat với dung dịch đồng sulfat
Cách này thường được sử dụng trong công nghiệp để sản xuất lượng lớn Cu(NO3)2.2H2O. Đầu tiên, kẽm nitơrat được trộn với dung dịch đồng sulfat để tạo thành Cu(NO3)2. Sau đó, dung dịch này được đun nóng để loại bỏ nước và tạo thành Cu(NO3)2.2H2O rắn.
Tính khử của Cu
Cu(NO3)2.2H2O là một chất oxy hóa mạnh, có khả năng oxi hóa các chất khác và bị khử thành đồng kim loại. Điều này có thể được quan sát rõ ràng khi cho một miếng nhôm vào dung dịch Cu(NO3)2.2H2O, sẽ xuất hiện một lớp màu đỏ trên bề mặt nhôm do sự khử của đồng từ dung dịch.
Tuy nhiên, Cu(NO3)2.2H2O cũng có tính khử khi tác dụng với các chất khác. Ví dụ, khi cho một miếng sắt vào dung dịch Cu(NO3)2.2H2O, sẽ xảy ra phản ứng khử và sản phẩm thu được là đồng kim loại và sắt nitơrat (Fe(NO3)2).
Tính chất vật lí của Cu(NO3)2.2H2O
Cu(NO3)2.2H2O là một chất rắn màu xanh lá cây, tan trong nước và không tan trong các dung môi hữu cơ. Nó có một số tính chất vật lí đáng chú ý như sau:
- Khối lượng phân tử: 241,60 g/mol
- Điểm nóng chảy: 114 °C
- Điểm sôi: 170 °C
- Tỷ trọng: 2,07 g/cm3
- Hàm lượng đồng: 36,5%
Tính chất hoá học của Cu(NO3)2.2H2O
Cu(NO3)2.2H2O là một chất oxy hóa mạnh và có tính ăn mòn cao. Nó có thể tác dụng với nhiều chất khác để tạo ra các sản phẩm khác nhau.
Tác dụng với axit
Khi tác dụng với axit, Cu(NO3)2.2H2O sẽ phân hủy thành đồng nitơrat (Cu(NO3)2) và nước. Ví dụ, khi cho dung dịch HCl vào dung dịch Cu(NO3)2.2H2O, sẽ thu được kết tủa trắng của đồng nitơrat.
Tác dụng với bazơ
Tương tự như với axit, Cu(NO3)2.2H2O cũng có thể phản ứng với bazơ để tạo ra các muối của đồng. Ví dụ, khi cho dung dịch NaOH vào dung dịch Cu(NO3)2.2H2O, sẽ thu được kết tủa xanh lá cây của đồng hydroxinitrat (Cu(OH)2).
Tác dụng với kim loại
Cu(NO3)2.2H2O có tính khử mạnh và có thể tác dụng với các kim loại khác để tạo ra các sản phẩm khác nhau. Ví dụ, khi cho một miếng nhôm vào dung dịch Cu(NO3)2.2H2O, sẽ xảy ra phản ứng khử và sản phẩm thu được là đồng kim loại và nhôm nitơrat (Al(NO3)3).
Ứng dụng của Cu(NO3)2.2H2O trong phân tích định lượng
Cu(NO3)2.2H2O có thể được sử dụng trong phân tích định lượng để xác định hàm lượng đồng trong các mẫu. Phương pháp này được gọi là phương pháp titrimetric hoặc phương pháp chuẩn độ. Đầu tiên, một lượng nhỏ Cu(NO3)2.2H2O được thêm vào mẫu cần phân tích. Sau đó, dung dịch NaOH được thêm dần vào cho đến khi xuất hiện một kết tủa xanh lá cây. Lượng NaOH đã sử dụng sẽ cho biết hàm lượng đồng trong mẫu.
Ứng dụng của Cu(NO3)2.2H2O trong sản xuất phân bón
Cu(NO3)2.2H2O cũng được sử dụng trong sản xuất phân bón như một nguồn cung cấp đồng. Đồng là một vi chất cần thiết cho sự phát triển của cây trồng và nó có thể được hấp thụ thông qua đất hoặc bằng cách phun lên lá cây. Sử dụng Cu(NO3)2.2H2O trong sản xuất phân bón giúp cung cấp đồng cho cây trồng một cách hiệu quả và an toàn.
Ứng dụng của Cu(NO3)2.2H2O trong bảo vệ thực vật và y tế
Cu(NO3)2.2H2O cũng có thể được sử dụng trong bảo vệ thực vật và y tế như một chất khử trùng. Nó có tính khử cao và có thể tiêu diệt các vi khuẩn, virus và nấm gây hại. Vì vậy, nó được sử dụng để xử lý các bệnh trên cây trồng và trong các sản phẩm y tế.
Điều chế và sản xuất Cu(NO3)2.2H2O
Để điều chế và sản xuất Cu(NO3)2.2H2O, ta có thể sử dụng hai phương pháp sau:
- Phương pháp trung hòa: Đầu tiên, dung dịch axit nitơric được trộn với dung dịch đồng sulfat để tạo thành Cu(NO3)2. Sau đó, dung dịch này được đun nóng để loại bỏ nước và tạo thành Cu(NO3)2.2H2O rắn.
- Phương pháp kết tủa: Đầu tiên, dung dịch axit nitơric được trộn với dung dịch đồng sulfat để tạo thành Cu(NO3)2. Sau đó, dung dịch này được đun nóng để loại bỏ nước và tạo thành Cu(NO3)2.2H2O rắn.
Kết luận
Cu(NO3)2.2H2O là một hợp chất quan trọng trong công nghiệp và khoa học. Nó có tính khử cao và có thể được sử dụng trong nhiều lĩnh vực như phân tích định lượng, sản xuất phân bón, bảo vệ thực vật và y tế. Việc điều chế và sản xuất Cu(NO3)2.2H2O có thể được thực hiện thông qua hai phương pháp trung hòa và kết tủa. Tuy nhiên, cần phải chú ý đến tính ăn mòn của chất này và đảm bảo an toàn khi sử dụng.
Mọi thắc mắc quý khách hàng xin vui lòng gửi về số Hotline 1900.868644 hoặc địa chỉ email [email protected] để được giải đáp. Trân trọng!

















