Điều Chế Muối CrCl2
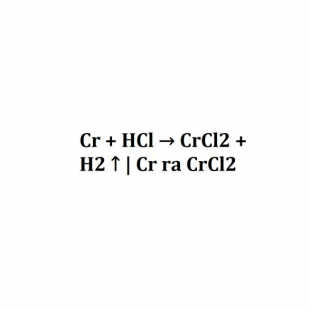
Muối crom (II) clorua (CrCl2) là một hợp chất hóa học quan trọng có nhiều ứng dụng trong công nghiệp và khoa học. Phản ứng giữa crom và axit hydrochloric là một trong những cách điều chế CrCl2 phổ biến.
Phương trình Phản Ứng Cơ Bản
Phản ứng giữa Cr và HCl có thể được mô tả bằng phương trình hóa học như sau:
Cr + 2HCl → CrCl2 + H2
Trong phản ứng này, crom (Cr) tác dụng với axit hydrochloric (HCl) để tạo ra muối crom (II) clorua (CrCl2) và khí hydro .
Điều Kiện Tiến Hành Phản Ứng
Để tiến hành phản ứng trên, cần đáp ứng các điều kiện sau:
- Nhiệt độ: Phản ứng thường diễn ra ở nhiệt độ phòng hoặc có thể gia tăng nhiệt độ nhẹ để tăng tốc độ phản ứng.
- Nồng độ axit: Sử dụng HCl với nồng độ thích hợp, thường là HCl nồng độ khoảng 6M.
- Sự tiếp xúc giữa Cr và HCl: Cần đảm bảo diện tích tiếp xúc giữa Cr và HCl lớn, ví dụ bằng cách sử dụng dạng bột hoặc dạng mảnh mỏng của Cr.
Khi các điều kiện trên được đáp ứng, phản ứng sẽ diễn ra nhanh chóng, tạo ra CrCl2 và H2.
Quy Trình Điều Chế CrCl2
Một quy trình điều chế CrCl2 từ Cr và HCl như sau:
- Cân lượng Cr và HCl phù hợp với phương trình phản ứng.
- Cho Cr (dạng bột hoặc mảnh) vào bình phản ứng.
- Thêm HCl vào bình phản ứng, khuấy đều.
- Để phản ứng diễn ra ở nhiệt độ phòng hoặc gia nhiệt nhẹ.
- Theo dõi sự sản sinh khí H2, khi không còn khí thoát ra nữa thì phản ứng đã hoàn tất.
- Lọc hoặc li tâm để tách CrCl2 ra khỏi dung dịch.
- Sấy khô CrCl2 thu được.
Quy trình này cho phép thu được muối CrCl2 tinh khiết, sử dụng làm nguyên liệu cho các ứng dụng khác.
Vai Trò của HCl trong Phản Ứng

Axit hydrochloric (HCl) giữ vai trò quan trọng trong phản ứng giữa Cr và HCl, cụ thể như sau:
Cung Cấp Các Ion Hydro
HCl là một axit mạnh, khi hòa tan trong nước sẽ tạo ra các ion hydro và ion clorid (Cl-) theo phương trình:
HCl → H+ + Cl-
Các ion H+ sẽ tham gia vào quá trình oxy hóa crom, khử Cr thành các ion Cr2+.
Tạo Môi Trường Axit
Sự hiện diện của HCl tạo ra một môi trường axit, có độ pH thấp. Môi trường axit này thúc đẩy quá trình tan của crom, giúp phản ứng diễn ra nhanh hơn.
Tạo Sản Phẩm CrCl2
Các ion Cl- từ HCl sẽ kết hợp với các ion Cr2+ để tạo ra muối CrCl2, sản phẩm chính của phản ứng.
Vì vậy, có thể nói rằng HCl đóng vai trò then chốt, vừa cung cấp các ion H+ để oxy hóa Cr, vừa tạo ra môi trường axit và các ion Cl- để tạo nên sản phẩm CrCl2 mong muốn.
Tính Chất Hóa Học của Cr
Crom (Cr) là một nguyên tố hóa học thuộc nhóm 6 trong bảng tuần hoàn, có số hiệu nguyên tử là 24. Nguyên tố này có nhiều tính chất hóa học đáng chú ý, ảnh hưởng đến quá trình xảy ra của phản ứng với HCl.
Trạng Thái Oxi Hóa của Cr
Crom có thể tồn tại ở các trạng thái oxi hóa khác nhau, chủ yếu là +2, +3 và +6. Trong phản ứng với HCl, Cr chủ yếu ở trạng thái oxi hóa +2, tạo ra ion Cr2+.
Tính Khử
Crom là một kim loại có tính khử khá cao, nó dễ bị oxy hóa và chuyển sang trạng thái oxi hóa cao hơn. Trong phản ứng với HCl, Cr bị oxy hóa, chuyển từ trạng thái oxi hóa 0 sang +2.
Tính Acid-Base
Ở trạng thái oxi hóa +2, các ion Cr2+ có tính axit Lewis, có thể tham gia phản ứng với các bazơ Lewis. Điều này ảnh hưởng đến các phản ứng tiếp theo của CrCl2.
Tính Điện Hóa
Crom có thế điện hóa tiêu chuẩn ở trạng thái oxi hóa 0 là -0,74V, cho thấy Cr là kim loại hoạt động, dễ bị oxy hóa. Điều này giải thích việc Cr dễ tham gia phản ứng với HCl.
Những tính chất hóa học của Cr như trạng thái oxi hóa, tính khử, acid-base và điện hóa đều ảnh hưởng đến cơ chế và diễn biến của phản ứng với HCl.
Tính Chất Vật Lý của Cr
Ngoài các tính chất hóa học, Cr còn có một số tính chất vật lý đáng chú ý:
Trạng Thái Vật Chất
Ở điều kiện thường, crom ở trạng thái rắn, là một kim loại cứng, bóng, màu xám bạc.
Nhiệt Độ Nóng Chảy và Sôi
Nhiệt độ nóng chảy của Cr là 1907°C, nhiệt độ sôi là 2671°C. Đây là những nhiệt độ khá cao, gây khó khăn trong việc gia công và sử dụng Cr.
Mật Độ
Mật độ của Cr ở 20°C là 7,19 g/cm³, cao hơn so với nhiều kim loại khác như sắt, nhôm.
Độ Cứng
Cr có độ cứng Mohs khoảng 8,5-9,0, cao hơn nhiều so với sắt và thép. Điều này giúp Cr có khả năng chịu mài mòn tốt.
Tính Dẫn Điện và Dẫn Nhiệt
Cr là một kim loại có tính dẫn điện và dẫn nhiệt khá tốt, phù hợp với các ứng dụng liên quan.
Những tính chất vật lý của Cr như trạng thái rắn, nhiệt độ nóng chảy cao, mật độ lớn, độ cứng cao và khả năng dẫn điện, dẫn nhiệt tốt cũng góp phần ảnh hưởng đến khả năng ứng dụng của Cr và các hợp chất của nó.
Các Ứng Dụng của Cr
Nhờ các tính chất ưu việt, Cr và các hợp chất của Cr có nhiều ứng dụng quan trọng trong công nghiệp, kỹ thuật và khoa học.
Ứng Dụng của Cr Kim Loại
- Hợp kim: Cr được sử dụng làm thành phần trong nhiều hợp kim như thép không gỉ, hợp kim với sắt, ni-ken, coban... để tăng cường độ cứng, khả năng chịu ăn mòn.
- Tráng phủ: Lớp mạ Cr trên bề mặt các sản phẩm kim loại giúp chúng có độ bóng, độ cứng và khả năng chống ăn mòn tốt hơn.
- Xúc tác: Cr được sử dụng làm chất xúc tác trong các quá trình công nghiệp như sản xuất amoniac, chuyển hóa dầu mỏ.
Ứng Dụng của CrCl2
- Hóa chất trung gian: CrCl2 là một chất trung gian quan trọng trong nhiều phản ứng hóa học, ví dụ như tổng hợp các hợp chất hữu cơ.
- Thuốc nhuộm: CrCl2 được dùng làm thuốc nhuộm, giúp cố định màu sắc trên các sợi vải.
- Chất oxy hóa khử: CrCl2 có tính khử mạnh, được sử dụng như một tác nhân oxy hóa-khử trong các phản ứng hóa học.
- Chất phụ gia: CrCl2 được dùng làm chất phụ gia trong sản xuất thép, nhôm, cao su để cải thiện tính chất.
Như vậy, Cr và CrCl2 đều có nhiều ứng dụng quan trọng trong các lĩnh vực công nghiệp, kỹ thuật và hóa học.
Cơ Chế Phản Ứng Giữa Cr và HCl
Phản ứng giữa Cr và HCl diễn ra theo một cơ chế hóa học cụ thể, bao gồm các bước sau:
Bước 1: Oxy Hóa Crom
Khi tiếp xúc với HCl, Cr bị oxy hóa từ trạng thái oxi hóa 0 lên +2, tạo thành ion Cr2+:
Cr(s) → Cr2+(aq) + 2e-
Quá trình này xảy ra do tính khử mạnh của Cr, thuận lợi trong môi trường axit của HCl.
Bước 2: Tạo Ion Clorid
Các ion Cl- từ HCl sẽ kết hợp với ion Cr2+ để tạo ra muối CrCl2:
Cr2+(aq) + 2Cl-(aq) → CrCl2(s)
Sản phẩm CrCl2 kết tủa ra khỏi dung dịch.
Bước 3: Phát Triển Khí Hydro
Đồng thời với quá trình tạo CrCl2, các ion H+ từ HCl sẽ bị khử, tạo thành khí hydro :
2H+(aq) + 2e- → H2(g)
Như vậy, cơ chế phản ứng giữa Cr và HCl bao gồm các bước oxy hóa Cr, tạo ion Cr2+, kết hợp với ion Cl- để tạo CrCl2 và phát triển khí H2. Đây là một chuỗi các phản ứng xảy ra đồng thời tạo thành các sản phẩm.
Nguy Hiểm của Phản Ứng Giữa Cr và HCl
Mặc dù phản ứng giữa Cr và HCl tạo ra các sản phẩm hữu ích, như CrCl2 và khí Hydro, nhưng cũng tồn tại các nguy hiểm:
Xử Lý An Toàn
Cần chú ý khi tiến hành phản ứng này vì Cr và HCl đều có tính chất ăn mòn. Việc tiếp xúc trực tiếp với chúng có thể gây kích ứng da, mắt và đường hô hấp. Do đó, cần tuân thủ các biện pháp an toàn.
Ô Nhiễm Môi Trường
Ngoài ra, phản ứng giữa Cr và HCl cũng có thể tạo ra sản phẩm phụ gây ô nhiễm môi trường, như các chất độc hại. Việc xử lý và xả thải sau phản ứng cần được thực hiện cẩn thận để đảm bảo không gây hại cho môi trường.
Nguy Cơ Về Sức Khỏe
Sự tiếp xúc lâu dài với Crom và axit hydroclorua trong quá trình phản ứng có thể gây nguy hiểm cho sức khỏe con người. Cần đeo bảo hộ cá nhân đầy đủ để bảo vệ cho sức khỏe khi làm việc với các chất này.
Việc hiểu rõ về các nguy hiểm có thể xuất hiện từ phản ứng giữa Cr và HCl là rất quan trọng để có thể áp dụng biện pháp an toàn và bảo vệ môi trường cũng như sức khỏe con người.
Biện Pháp An Toàn Khi Sử Dụng Cr và HCl
Để đảm bảo an toàn cho quá trình phản ứng giữa Crom và axit Hydroclorua, cần thực hiện các biện pháp sau:
Sử Dụng Bảo Hộ Cá Nhân
Khi tiếp xúc với Cr và HCl, cần đeo đồ bảo hộ cá nhân đầy đủ bao gồm kính bảo hộ, găng tay, áo choàng, khẩu trang để bảo vệ da và hệ hô hấp.
Điều Trị Chất Thải Đúng Cách
Sau khi kết thúc phản ứng, cần xử lý các chất thải theo quy định của cơ quan chức năng để đảm bảo không gây hại cho môi trường và sức khỏe con người.
Sử Dụng Trang Thiết Bị Quy Chuẩn
Khi thực hiện phản ứng giữa Cr và HCl, cần sử dụng trang thiết bị đảm bảo chất lượng và tuân thủ các quy chuẩn an toàn để tránh tai nạn không mong muốn.
Việc áp dụng các biện pháp an toàn khi sử dụng Cr và HCl không chỉ bảo vệ cho người thực hiện mà còn đảm bảo an toàn cho các quy trình công việc và môi trường xung quanh.
Kết Luận
Trong bài viết này, chúng ta đã tìm hiểu về phản ứng giữa Crom và axit Hydroclorua để điều chế muối CrCl2, vai trò của HCl trong phản ứng, tính chất hóa học và vật lý của Crom, cũng như các ứng dụng của Cr và CrCl2 trong công nghiệp và hóa học. Chúng ta cũng đã đào sâu vào cơ chế phản ứng giữa Cr và HCl, nguy hiểm có thể xuất hiện và biện pháp an toàn khi sử dụng Cr và HCl. Hi vọng rằng những kiến thức này sẽ giúp bạn hiểu rõ hơn về Cr và ứng dụng của nó trong thực tế.
Mọi thắc mắc quý khách hàng xin vui lòng gửi về số Hotline 1900.868644 hoặc địa chỉ email [email protected] để được giải đáp. Trân trọng!

















