Điều kiện phản ứng

Nhiệt độ và áp suất
Nhiệt độ và áp suất là hai yếu tố quan trọng ảnh hưởng đến tốc độ và hiệu suất của phản ứng hóa học Ca(OH)2 + NaHCO3 → CaCO3 ↓ + H2O + NaOH. Thông thường, tăng nhiệt độ và áp suất sẽ làm tăng tốc độ phản ứng và đạt được hiệu suất cao hơn.
Điều kiện pH
Điều kiện pH của môi trường cũng có thể ảnh hưởng đến quá trình phản ứng. Trong trường hợp này, việc điều chỉnh pH của dung dịch có thể cần thiết để đạt được kết quả mong muốn của phản ứng.
Cân bằng phản ứng
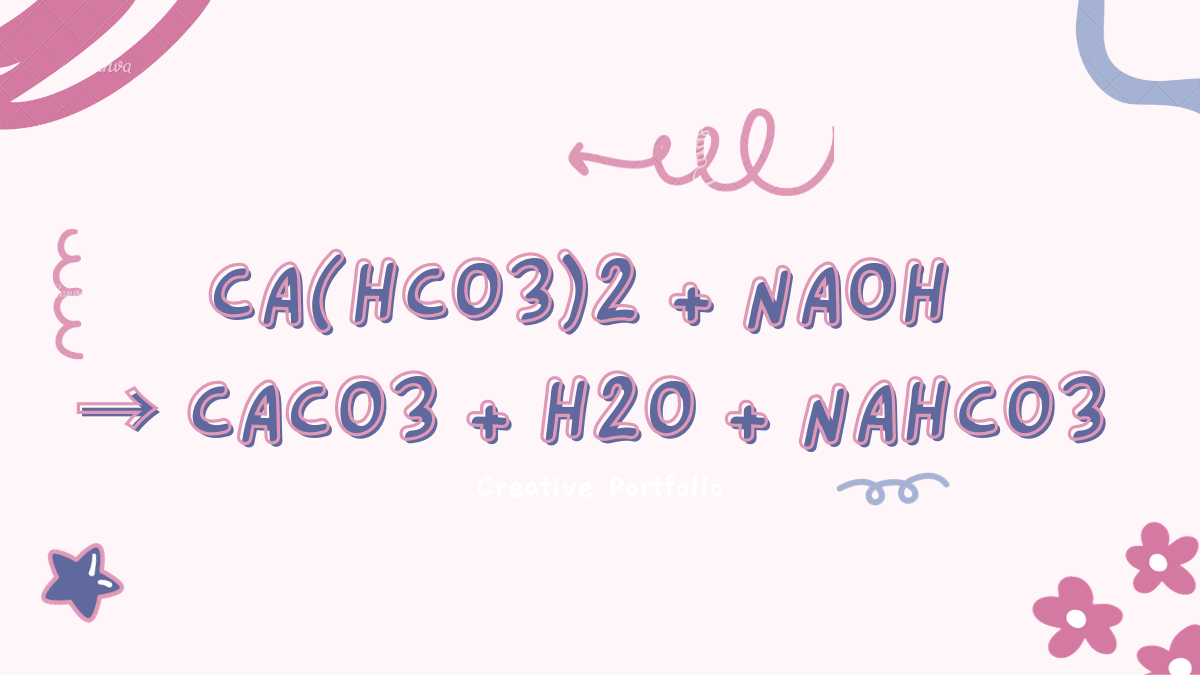
Phản ứng hóa học Ca(OH)2 + NaHCO3 → CaCO3 ↓ + H2O + NaOH có thể đạt tới cân bằng khi tất cả các chất tham gia và sản phẩm đều ở tỷ lệ cố định. Khi đạt được cân bằng, tốc độ phản ứng tiến và phản ứng ngược bằng nhau và không có sự thay đổi về nồng độ các chất.
Công thức cân bằng
Công thức cân bằng của phản ứng này có thể được biểu diễn như sau: Ca(OH)2 + 2NaHCO3 → CaCO3 ↓ + 2H2O + 2NaOH
Điều chỉnh cân bằng
Để điều chỉnh cân bằng phản ứng, chúng ta có thể thay đổi nhiệt độ, áp suất, hoặc nồng độ các chất tham gia để đạt được tỷ lệ mong muốn giữa chúng.
Ứng dụng phản ứng
Phản ứng giữa Ca(OH)2 và NaHCO3 mang lại nhiều ứng dụng trong cuộc sống hàng ngày, từ công nghiệp đến gia đình.
Trong công nghiệp
Trong công nghiệp xử lý nước, phản ứng này được sử dụng để tạo ra Canxi cacbonat (CaCO3) và Natri hidroxit (NaOH) từ Canxi hydroxit (Ca(OH)2) và Natri hidrocacbonat (NaHCO3). CaCO3 có thể được sử dụng để làm sạch nước bằng cách loại bỏ các ion kim loại nặng có trong nước.
Trong gia đình
Trong gia đình, phản ứng này cũng được sử dụng để làm sạch các bề mặt bằng cách tạo ra một dung dịch kiềm yếu từ NaOH để phản ứng với chất bẩn và bã nhờn, giúp làm sạch hiệu quả.
Tính chất của Ca(OH)2
Canxi hydroxit (Ca(OH)2) là một hợp chất kiềm yếu có nhiều ứng dụng trong sinh học và công nghiệp.
Tính chất vật lý
- Dạng rắn màu trắng
- Tan trong nước, tạo ra dung dịch kiềm
- Tinh thể 6 cạnh
Tính chất hóa học
- Là chất bazơ kiềm yếu
- Phản ứng với axit tạo ra muối và nước
- Phản ứng với Natri hidrocacbonat tạo ra Canxi cacbonat, nước và Natri hidroxit
Ứng dụng
- Trong xây dựng để làm vữa chống thấm
- Trong nông nghiệp để làm phân bón canxi
Tính chất của NaHCO3
Natri hidrocacbonat (NaHCO3) là một hợp chất phổ biến được sử dụng trong nấu ăn và làm sạch.
Tính chất vật lý
- Dạng bột màu trắng
- Tan trong nước
- Có vị kiềm
Tính chất hóa học
- Phản ứng với axit tạo ra muối, nước và CO2
- Phản ứng với Canxi hydroxit tạo ra Canxi cacbonat, nước và Natri hidroxit
Ứng dụng
- Trong nấu ăn để nổi bánh
- Trong làm sạch để tạo ra dung dịch kiềm
Tính chất của CaCO3
Canxi cacbonat (CaCO3) là một chất rắn phổ biến có nhiều ứng dụng trong công nghiệp và sinh học.
Tính chất vật lý
- Dạng tinh thể trắng
- Khó tan trong nước
- Là thành phần chính của vôi
Tính chất hóa học
- Là chất bazơ yếu
- Phản ứng với axit tạo ra muối, nước và CO2
- Được sử dụng trong công nghiệp chế biến thức ăn
Ứng dụng
- Trong sản xuất giấy
- Trong sản xuất thức ăn cho gia súc
Tính chất của H2O
Nước (H2O) là chất lỏng quen thuộc và quan trọng trong tự nhiên và cuộc sống.
Tính chất vật lý
- Dạng chất lỏng trong suốt
- Có khối lượng riêng cao
- Điểm sôi và đóng băng ở nhiệt độ phổ biến
Tính chất hóa học
- Dung môi phổ biến trong phản ứng hóa học
- Tham gia nhiều phản ứng hóa học khác nhau
- Là sản phẩm chính của nhiều phản ứng oxi hóa khử
Ứng dụng
- Trong sản xuất thức uống và thực phẩm
- Trong công nghiệp hóa chất
Tính chất của NaOH
Natri hidroxit (NaOH) là một hợp chất kiềm mạnh có nhiều ứng dụng trong công nghiệp và hóa học.
Tính chất vật lý
- Dạng hạt màu trắng
- Tan trong nước
- Có tính ăn mòn với da
Tính chất hóa học
- Là chất bazơ mạnh
- Phản ứng với axit tạo ra muối và nước
- Phản ứng với dẫn xuất halogen để tạo ra halid
Ứng dụng
- Trong sản xuất xà phòng
- Trong sản xuất giấy
Bảo quản và sử dụng hóa chất
Để bảo quản và sử dụng hóa chất an toàn, cần tuân thủ các quy tắc sau:
- Bảo quản trong điều kiện khô ráo, thoáng mát, tránh ánh nắng trực tiếp
- Sử dụng dung cụ bảo hộ khi tiếp xúc với hóa chất
- Luôn luôn đọc kỹ hướng dẫn sử dụng trước khi xử lý hóa chất
Kết luận
Trong bài viết này, chúng ta đã tìm hiểu về phản ứng hóa học giữa Ca(OH)2 và NaHCO3, bao gồm điều kiện và cân bằng phản ứng, ứng dụng của phản ứng, cũng như tính chất của các chất tham gia và sản phẩm trong phản ứng. Việc hiểu rõ về các yếu tố này không chỉ giúp chúng ta áp dụng phản ứng vào thực tế một cách hiệu quả mà còn giữ cho môi trường xung quanh an toàn.
Mọi thắc mắc quý khách hàng xin vui lòng gửi về số Hotline 1900.868644 hoặc địa chỉ email [email protected] để được giải đáp. Trân trọng!

















