Trong bài viết này, chúng ta sẽ tìm hiểu chi tiết về quá trình oxy hóa ion sắt (II) [Fe(OH)2] thành ion sắt (III) [Fe(OH)3], bao gồm cơ chế phản ứng, điều kiện, yếu tố ảnh hưởng và ứng dụng thực tế của quá trình này.
Phản ứng của Fe(OH)2 với oxy và nước
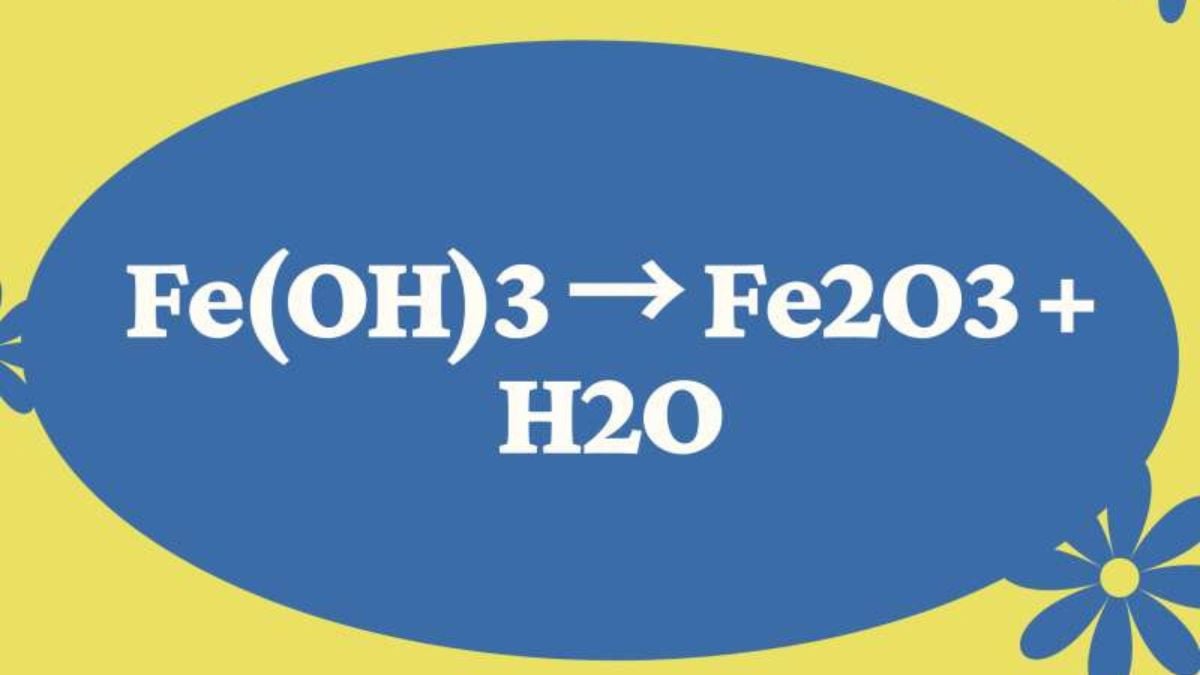
Sự hình thành Fe(OH)3 từ Fe(OH)2 thông qua phản ứng oxy hóa
Khi ion sắt (II) [Fe(OH)2] tiếp xúc với oxy (O2) và nước (H2O) trong môi trường lưỡng tính (pH trung tính hoặc kiềm), sẽ xảy ra phản ứng oxy hóa, dẫn đến sự chuyển đổi Fe(OH)2 thành Fe(OH)3. Phản ứng hóa học có thể được biểu diễn như sau:
Fe(OH)2 + O2 + H2O → Fe(OH)3
Trong phản ứng này, ion sắt (II) [Fe(OH)2] được oxy hóa thành ion sắt (III) [Fe(OH)3]. Oxy (O2) đóng vai trò là chất oxy hóa, còn nước (H2O) cung cấp proton để tạo thành Fe(OH)3.
Quá trình này diễn ra ở nhiệt độ và áp suất thường, thường kèm theo sự kết tủa của Fe(OH)3 dưới dạng một kết tủa kết tinh màu nâu đỏ. Sản phẩm cuối cùng của phản ứng là Fe(OH)3, một chất rắn kết tinh, có thể được sử dụng trong nhiều ứng dụng khác nhau.
Vai trò của oxy trong quá trình chuyển đổi Fe(OH)2 thành Fe(OH)3
Oxy (O2) là một chất oxy hóa mạnh, đóng vai trò quan trọng trong quá trình chuyển đổi Fe(OH)2 thành Fe(OH)3. Cụ thể, oxy tham gia vào phản ứng oxy hóa, làm tăng số oxy hóa của sắt từ +2 (Fe2+) lên +3 (Fe3+).
Sự hiện diện của oxy là cần thiết để quá trình oxy hóa diễn ra, bởi vì oxy sẽ cung cấp electron để oxy hóa Fe(OH)2 thành Fe(OH)3. Nếu thiếu oxy, phản ứng sẽ không thể xảy ra hoặc diễn ra rất chậm.
Ngoài ra, oxy còn tham gia vào quá trình kết tủa Fe(OH)3 từ các ion Fe3+ trong dung dịch, góp phần hình thành sản phẩm cuối cùng của phản ứng.
Cơ chế phản ứng của Fe(OH)2 với O2 và H2O
Các bước của phản ứng oxy hóa Fe(OH)2
Quá trình oxy hóa Fe(OH)2 thành Fe(OH)3 bao gồm các bước sau:
- Oxy hóa ion sắt (II) [Fe(OH)2] thành ion sắt (III) [Fe(OH)3]:
- Fe(OH)2 + O2 → 2 Fe(OH)3
- Kết tủa Fe(OH)3 từ các ion Fe3+ trong dung dịch:
- Fe3+ + 3 OH- → Fe(OH)3 (s)
Trong bước đầu tiên, oxy (O2) đóng vai trò là chất oxy hóa, nhận electron từ Fe(OH)2 để tạo thành Fe(OH)3. Điều này làm tăng số oxy hóa của sắt từ +2 lên +3.
Ở bước thứ hai, các ion Fe3+ kết hợp với các ion hydroxyl (OH-) trong dung dịch để hình thành kết tủa Fe(OH)3. Quá trình này xảy ra khi nồng độ các ion Fe3+ và OH- vượt quá giới hạn hòa tan.
Điều kiện thuận lợi cho phản ứng
Để phản ứng oxy hóa Fe(OH)2 thành Fe(OH)3 diễn ra tốt, cần đảm bảo một số điều kiện sau:
- Môi trường lưỡng tính (pH trung tính hoặc kiềm):
- Phản ứng xảy ra tốt nhất trong khoảng pH từ 6 đến 14, tức là ở môi trường lưỡng tính hoặc kiềm.
- Ở môi trường axit (pH thấp), quá trình oxy hóa sẽ bị ức chế.
- Sự có mặt của oxy (O2):
- Oxy là chất oxy hóa không thể thiếu trong phản ứng chuyển đổi Fe(OH)2 thành Fe(OH)3.
- Nồng độ oxy càng cao, tốc độ phản ứng càng nhanh.
- Nhiệt độ thích hợp:
- Phản ứng diễn ra tốt nhất ở nhiệt độ phòng (khoảng 20-25°C).
- Ở nhiệt độ thấp hơn, tốc độ phản ứng sẽ chậm lại.
- Ở nhiệt độ cao hơn, Fe(OH)3 có thể bị phân hủy thành các sản phẩm khác.
- Thời gian phản ứng:
- Phản ứng chuyển đổi Fe(OH)2 thành Fe(OH)3 cần một khoảng thời gian nhất định để hoàn thành.
- Thời gian phản ứng thường kéo dài từ vài phút đến vài giờ, tùy thuộc vào các điều kiện khác.
Việc kiểm soát tốt các yếu tố này sẽ giúp quá trình oxy hóa Fe(OH)2 thành Fe(OH)3 diễn ra một cách hiệu quả.
Tính chất hóa học của Fe(OH)2 và Fe(OH)3
Tính chất của Fe(OH)2
Fe(OH)2 là một chất rắn kết tinh, có màu xanh lam hoặc xanh lục, thường được tạo thành khi các ion sắt (II) [Fe2+] kết hợp với các ion hydroxyl (OH-) trong dung dịch.
Một số tính chất đặc trưng của Fe(OH)2 như sau:
- Dạng kết tinh, không tan trong nước, dễ bị oxy hóa trong không khí.
- Có tính lưỡng tính, có thể phản ứng với cả axit và bazơ.
- Là chất khử, dễ bị oxy hóa thành ion sắt (III) [Fe(OH)3].
- Ở nhiệt độ cao, Fe(OH)2 có thể bị phân hủy thành Fe3O4 (từ tính).
Tính chất của Fe(OH)3
Fe(OH)3 là một chất rắn kết tinh, có màu nâu đỏ, thường được tạo thành khi các ion sắt (III) [Fe3+] kết hợp với các ion hydroxyl (OH-) trong dung dịch.
Một số tính chất đặc trưng của Fe(OH)3 như sau:
- Dạng kết tinh, không tan trong nước, khá bền vững trong không khí.
- Có tính lưỡng tính, có thể phản ứng với cả axit và bazơ.
- Là chất oxy hóa, có thể oxy hóa các chất khử khác.
- Ở nhiệt độ cao, Fe(OH)3 có thể bị phân hủy thành các oxit sắt như Fe2O3 và Fe3O4.
Sự khác biệt về tính chất hóa học giữa Fe(OH)2 và Fe(OH)3 phản ánh sự khác nhau về số oxy hóa của sắt, từ +2 (Fe2+) đến +3 (Fe3+). Điều này ảnh hưởng đến tính chất và ứng dụng của hai chất này trong các lĩnh vực khác nhau.
Ứng dụng của phản ứng Fe(OH)2 + O2 + H2O → Fe(OH)3
Vai trò trong xử lý nước và nước thải
Phản ứng oxy hóa Fe(OH)2 thành Fe(OH)3 có ứng dụng quan trọng trong xử lý nước và nước thải. Cụ thể:
- Khử sắt (II) trong nước: Fe(OH)2 có thể được oxy hóa thành Fe(OH)3 để loại bỏ các ion sắt (II) từ nguồn nước, cải thiện chất lượng nước.
- Xử lý nước thải: Fe(OH)3 kết tủa có thể được sử dụng để loại bỏ các kim loại nặng, phosphate và các chất ô nhiễm khác trong nước thải.
- Nâng cao hiệu quả lắng: Sự hình thành kết tủa Fe(OH)3 giúp các chất lơ lửng trong nước lắng xuống nhanh hơn, tăng hiệu quả lắng và làm trong nước.
Ứng dụng trong sản xuất pigment và chất xúc tác
Phản ứng oxy hóa Fe(OH)2 thành Fe(OH)3 còn được ứng dụng trong:
- Sản xuất pigment: Fe(OH)3 là nguyên liệu quan trọng để sản xuất các loại màu sắc như oxit sắt (III) (Fe2O3) và oxit sắt (II,III) (Fe3O4), được sử dụng rộng rãi trong công nghiệp sơn, mực in, mỹ phẩm, v.v.
- Chế tạo chất xúc tác: Fe(OH)3 có thể được sử dụng để tạo ra các chất xúc tác dựa trên sắt, ứng dụng trong nhiều lĩnh vực như lọc khí, xử lý nước, công nghiệp hóa chất, v.v.
Các ứng dụng khác
Ngoài các ứng dụng trên, phản ứng oxy hóa Fe(OH)2 thành Fe(OH)3 còn có thể được áp dụng trong:
- Y tế: Fe(OH)3 được sử dụng làm chất bổ sung sắt trong các loại thuốc và thực phẩm chức năng để điều trị thiếu máu do thiếu sắt.
- Địa chất: Quá trình oxy hóa Fe(OH)2 được quan sát trong các môi trường địa chất, ảnh hưởng đến tính chất của đất, trầm tích và các quặng sắt.
- Công nghiệp: Fe(OH)3 có thể được sử dụng làm chất phụ gia trong sản xuất xi măng, gốm sứ, thủy tinh, v.v.
Như vậy, phản ứng oxy hóa Fe(OH)2 thành Fe(OH)3 có ý nghĩa rất lớn trong nhiều lĩnh vực, từ xử lý môi trường, công nghiệp cho đến y tế và địa chất.
Điều kiện phản ứng để tạo ra Fe(OH)3 từ Fe(OH)2
Yếu tố ảnh hưởng đến tốc độ phản ứng
Tốc độ của phản ứng oxy hóa Fe(OH)2 thành Fe(OH)3 phụ thuộc vào các yếu tố sau:
- pH môi trường:
- Phản ứng diễn ra nhanh nhất ở môi trường lưỡng tính hoặc kiềm (pH 6-14).
- Ở môi trường axit (pH thấp), tốc độ phản ứng sẽ chậm lại do sự ức chế của proton .
- Nồng độ oxy (O2):
- Nồng độ oxy càng cao, tốc độ phản ứng càng nhanh, do oxy đóng vai trò chất oxy hóa.
- Trong môi trường kín hoặc thiếu oxy, phản ứng sẽ diễn ra rất chậm hoặc không xảy ra. - Sự hiện diện của oxy là yếu tố quan trọng quyết định sự thành công của quá trình chuyển đổi Fe(OH)2 thành Fe(OH)3.
- Nhiệt độ:
- Phản ứng thường diễn ra nhanh hơn ở nhiệt độ cao do tăng động năng lượng phân tử, tạo điều kiện thuận lợi cho các phản ứng hóa học xảy ra.
- Tuy nhiên, quá nhiệt độ cao có thể gây phân hủy hoặc làm mất tính ổn định của sản phẩm Fe(OH)3.
Các yếu tố khác
Ngoài các yếu tố cơ bản như pH, nồng độ oxy và nhiệt độ, còn có một số yếu tố khác ảnh hưởng đến tốc độ phản ứng:
- Kích thước hạt: Hạt lớn thường có diện tích tiếp xúc lớn hơn, giúp phản ứng diễn ra nhanh hơn.
- Ánh sáng: Năng lượng ánh sáng có thể kích thích một số phản ứng phụ hoặc tăng tốc độ của phản ứng chính.
- Các chất xúc tác: Có thể có một số chất xúc tác có thể tăng tốc độ hoặc nâng cao hiệu suất của phản ứng oxy hóa này.
Những yếu tố trên cùng sẽ quyết định đến việc điều chỉnh điều kiện phản ứng để tạo ra Fe(OH)3 từ Fe(OH)2 một cách hiệu quả và nhanh chóng, ứng dụng trong các lĩnh vực khác nhau theo nhu cầu cụ thể.
Ý nghĩa của phản ứng Fe(OH)2 + O2 + H2O → Fe(OH)3
Phản ứng oxy hóa Fe(OH)2 thành Fe(OH)3 mang lại nhiều ý nghĩa quan trọng:
- Xử lý môi trường: Quá trình này được áp dụng rộng rãi trong việc xử lý nước và nước thải, giúp loại bỏ các chất ô nhiễm và cải thiện chất lượng nước.
- Sản xuất công nghiệp: Fe(OH)3 từ phản ứng này được sử dụng để sản xuất pigment, chất xúc tác và các sản phẩm công nghiệp khác.
- Ứng dụng trong y tế: Fe(OH)3 có thể được sử dụng trong ngành y dược để sản xuất thuốc bổ sung sắt.
- Đóng vai trò trong nghiên cứu khoa học: Quá trình oxy hóa Fe(OH)2 mở ra nhiều cơ hội nghiên cứu trong lĩnh vực hóa học và môi trường.
Với những ứng dụng và ý nghĩa đa dạng, phản ứng oxy hóa Fe(OH)2 thành Fe(OH)3 đóng vai trò quan trọng và không thể phủ nhận trong nhiều lĩnh vực khác nhau.
Kết luận
Trong bối cảnh quá trình oxy hóa Fe(OH)2 thành Fe(OH)3, chúng ta đã tìm hiểu về cơ chế phản ứng, vai trò của oxy, tính chất hóa học của Fe(OH)2 và Fe(OH)3, ứng dụng của phản ứng, điều kiện cần thiết và các yếu tố ảnh hưởng đến tốc độ phản ứng. Việc hiểu rõ về quá trình này không chỉ giúp chúng ta áp dụng hiệu quả trong thực tiễn mà còn mở ra nhiều cơ hội nghiên cứu và ứng dụng mới trong tương lai.
Ứng chuyển đổi Fe(OH)2 thành Fe(OH)3 cần một khoảng thời gian nhất định để hoàn thành.
- Thời gian phản ứng thường kéo dài từ vài phút đến vài giờ, tùy thuộc vào các điều kiện khác.
Việc kiểm soát tốt các yếu tố này sẽ giúp quá trình oxy hóa Fe(OH)2 thành Fe(OH)3 diễn ra một cách hiệu quả.

















