Chất điện li là gì?

Chất điện li (electrolyte) là một loại chất hóa học khi được hòa tan trong dung môi, đặc biệt là nước, sẽ tách ra thành các ion tự do. Những chất này có khả năng dẫn điện khi ở dạng hòa tan hoặc nóng chảy. Khi một chất điện li được hòa tan, các phân tử của chất sẽ bị phân cực và tách ra thành các ion mang điện tích dương (cation) và ion mang điện tích âm (anion).
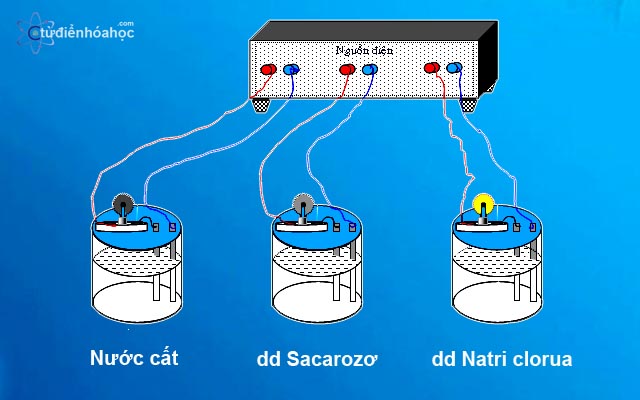
Ví dụ điển hình về chất điện li là muối ăn (natri clorua - NaCl). Khi muối ăn được hòa tan trong nước, các phân tử NaCl sẽ tách ra thành ion Na+ (natri dương) và ion Cl- (clorua âm). Sự tách ra này được gọi là sự điện li.
Chất điện li có thể chia thành hai loại chính là chất điện li mạnh và chất điện li yếu.
Phân loại chất điện li mạnh và chất điện li yếu
Chất điện li mạnh
Chất điện li mạnh (strong electrolyte) là những chất hóa học khi được hòa tan trong dung môi, đặc biệt là nước, sẽ có tỷ lệ ion hóa hoàn toàn. Nghĩa là, khi hòa tan, hầu như toàn bộ phân tử của chất sẽ bị phân cực và tách ra thành các ion tự do. Điều này có nghĩa là khi các chất điện li mạnh hòa tan trong nước, sẽ có rất ít hoặc không có phân tử nguyên thủy còn tồn tại.
Một số ví dụ về chất điện li mạnh:
- Các axit vô cơ mạnh: Axit hydrocloric (HCl), axit sulfuric (H2SO4), axit nitric (HNO3).
- Các bazơ vô cơ mạnh: Natri hydroxyt (NaOH), kali hydroxyt (KOH).
- Các muối hòa tan trong nước: Natri clorua (NaCl), kali nitrat (KNO3), magie sunfat (MgSO4).
Các chất điện li mạnh có độ điện li gần như 100%, nghĩa là khi hòa tan, chúng sẽ tách ra thành các ion với tỷ lệ gần như hoàn toàn.
Chất điện li yếu
Chất điện li yếu (weak electrolyte) là những chất hóa học khi được hòa tan trong dung môi, đặc biệt là nước, sẽ chỉ có một phần nhỏ phân tử bị phân cực và tách ra thành các ion tự do. Nghĩa là, khi hòa tan, chỉ một phần nhỏ phân tử của chất sẽ bị ion hóa, phần lớn vẫn tồn tại dưới dạng phân tử nguyên thủy.
Một số ví dụ về chất điện li yếu:
- Axit acetic (CH3COOH)
- Amoniac (NH3)
- Axit cacbonic (H2CO3)
- Axit hypoclorơ (HOCl)
Các chất điện li yếu có độ điện li nhỏ hơn 100%, thường từ 1 đến 5%. Điều này có nghĩa là khi hòa tan, chỉ một phần nhỏ phân tử của chất sẽ bị tách ra thành các ion, phần lớn vẫn tồn tại dưới dạng phân tử nguyên thủy.
So sánh chất điện li mạnh và chất điện li yếu
Sự khác biệt cơ bản giữa chất điện li mạnh và chất điện li yếu nằm ở tỷ lệ phân ly thành các ion tự do khi hòa tan trong dung môi.
Chất điện li mạnh sẽ có độ điện li gần như hoàn toàn (khoảng 100%), nghĩa là hầu như toàn bộ phân tử sẽ bị phân ly thành các ion tự do. Trong khi đó, chất điện li yếu chỉ có một phần nhỏ phân tử bị phân ly thành ion (từ 1 đến 5%), phần lớn vẫn tồn tại dưới dạng phân tử nguyên thủy.
Điều này dẫn đến một số khác biệt cơ bản giữa hai loại chất điện li này về tính chất và ứng dụng. Chẳng hạn, chất điện li mạnh thường có khả năng dẫn điện tốt hơn, pH của dung dịch chúng cũng thay đổi mạnh hơn so với chất điện li yếu.
Thuyết Areniux về sự điện li
Thuyết về sự điện li được đề xuất lần đầu tiên vào năm 1887 bởi nhà hóa học người Thụy Điển Svante Arrhenius. Thuyết này giải thích về sự phân cực và tách ra các ion tự do khi các chất điện li được hòa tan trong dung môi, đặc biệt là nước.
Theo Arrhenius, khi một chất điện li như muối, axit hay bazơ được hòa tan trong nước, các phân tử của chất sẽ bị phân cực và tách ra thành các ion mang điện tích dương (cation) và ion mang điện tích âm (anion). Quá trình này được gọi là sự điện li.
Ví dụ, khi muối ăn (natri clorua - NaCl) được hòa tan trong nước, các phân tử NaCl sẽ bị phân cực và tách ra thành ion Na+ (natri dương) và ion Cl- (clorua âm):
NaCl → Na+ + Cl-
Sự phân li như vậy làm cho dung dịch có khả năng dẫn điện, vì các ion tự do có thể di chuyển và truyền dòng điện.
Theo Arrhenius, độ điện li của một chất phụ thuộc vào:
- Cấu trúc phân tử của chất điện li.
- Sức hút giữa các ion tạo thành.
- Tính chất của dung môi.
Chẳng hạn, các chất điện li mạnh như axit hydrocloric (HCl) hay natri hydroxyt (NaOH) có độ điện li gần như hoàn toàn (100%) khi hòa tan trong nước. Trong khi đó, các chất điện li yếu như axit acetic (CH3COOH) chỉ có một phần nhỏ phân tử bị phân ly thành ion (độ điện li khoảng 1-5%).
Thuyết Arrhenius về sự điện li đã giải thích được nhiều hiện tượng liên quan đến tính chất của các dung dịch điện li, như khả năng dẫn điện, tính axit-bazơ, phản ứng oxi hóa khử, v.v. Đây là một trong những thành tựu quan trọng của hóa học đầu thế kỷ 20.
Thuyết Bronsted - Lowry về sự điện li
Mặc dù thuyết Arrhenius đã giải thích được nhiều hiện tượng liên quan đến sự điện li, nhưng nó vẫn còn một số hạn chế. Vào năm 1923, các nhà hóa học Johannes Bronsted và Thomas Lowry đã đưa ra một quan điểm mới về sự điện li, được gọi là thuyết Bronsted - Lowry.
Theo thuyết Bronsted - Lowry, sự điện li được định nghĩa như sự trao đổi proton giữa các chất. Cụ thể:
- Một chất có khả năng đưa proton ra ngoài được gọi là axit.
- Một chất có khả năng nhận proton được gọi là bazơ.
- Sự điện li xảy ra khi axit trao đổi proton với bazơ.
Ví dụ, khi axit hydrocloric (HCl) được hòa tan trong nước, nó sẽ trao đổi proton với nước (H2O) và tạo ra ion hydro (H3O+) và ion clorua (Cl-):
HCl + H2O ⇌ H3O+ + Cl-
Trong đó, HCl là axit vì nó đưa proton ra ngoài, còn H2O là bazơ vì nó nhận proton .
Thuyết Bronsted - Lowry mở rộng phạm vi của sự điện li so với thuyết Arrhenius. Nó không chỉ giải thích được sự điện li của các axit, bazơ và muối mà còn áp dụng được cho các phản ứng trao đổi proton khác trong hóa học.
Ví dụ, khi NH3 (amoniac) hòa tan trong nước, nó sẽ nhận proton từ nước và tạo ra ion amoni (NH4+) và ion hydroxit (OH-):
NH3 + H2O ⇌ NH4+ + OH-
Như vậy, NH3 là một bazơ vì nó nhận proton, còn H2O là một axit vì nó đưa proton ra ngoài.
Thuyết Bronsted - Lowry đã mở rộng và bổ sung thêm nhiều khái niệm quan trọng trong hóa học, như cặp axit-bazơ liên conjugate, pH, pKa, v.v. Đây là một trong những thành tựu quan trọng của hóa học hiện đại.
Độ điện li
Độ điện li (degree of ionization) là một thông số quan trọng để mô tả mức độ phân ly của các chất điện li khi hòa tan trong dung môi.
Độ điện li được ký hiệu là α (alpha) và được định nghĩa là tỷ lệ phần số mol các ion tự do so với tổng số mol chất điện li ban đầu khi hòa tan trong dung môi.
Công thức tính độ điện li:
α = (số mol các ion tự do) / (tổng số mol chất điện li ban đầu)
Ví dụ, khi 1 mol NaCl được hòa tan trong nước, nếu 0,9 mol NaCl bị phân ly thành các ion Na+ và Cl-, thì độ điện li của NaCl sẽ là:
α = 0,9 / 1 = 0,9 = 90%
Như vậy, độ điện li của NaCl là 90%, nghĩa là 90% số phân tử NaCl ban đầu đã bị phân ly thành các ion tự do.
Độ điện li của các chất điện li có những đặc điểm sau:
- Chất điện li mạnh có độ điện li gần như 100%.
- Chất điện li yếu có độ điện li thấp, thường chỉ từ 1 đến 5%.
- Độ điện li phụ thuộc vào nhiệt độ, nồng độ và tính chất của dung môi.
Độ điện li là một thông số quan trọng vì nó ảnh hưởng trực tiếp đến nhiều tính chất của dung dịch, như khả năng dẫn điện, độ pH, hiệu ứng oxi hóa khử, v.v.
Các yếu tố ảnh hưởng đến sự điện li
Sự điện li của các chất phụ thuộc vào nhiều yếu tố, bao gồm:
1. Bản chất của chất điện li
- Chất điện li mạnh có độ điện li cao, gần như 100%.
- Chất điện li yếu có độ điện li thấp, thường chỉ từ 1 đến 5%.
2. Tính chất của dung môi
- Dung môi có độ phân cực cao như nước thì sẽ làm tăng độ điện li của chất tan.
- Dung môi có độ phân cực thấp như benzen thì sẽ làm giảm độ điện li.
3. Nồng độ của dung dịch
- Ở nồng độ cao, sự điện li của chất điện li yếu sẽ bị ức chế do hiệu ứng ion chung.
- Ở nồng độ thấp, sự điện li của chất điện li yếu sẽ tăng lên.
4. Nhiệt độ
- Độ điện li thường tăng theo nhiệt độ vì nó kích thích quá trình phân ly ion.
- Tuy nhiên, có một số trường hợp độ điện li giảm theo nhiệt độ do hiện tượng cân bằng dịch chuyển.
Những yếu tố này cùng tác động và tương tác với nhau để quyết định độ điện li của một chất trong một dung dịch cụ thể.
Các ứng dụng của sự điện li
Sự điện li không chỉ là một khái niệm lý thuyết mà còn có rất nhiều ứng dụng thực tiễn trong cuộc sống và công nghiệp. Dưới đây là một số ứng dụng phổ biến của sự điện li:
1. Dẫn điện trong dung dịch
- Sự điện li giúp dung dịch dẫn điện, làm cho nước biến thành dung môi dẫn điện tốt.
- Ứng dụng trong việc tạo ra dung dịch điện phân, điện cực dung dịch, v.v.
2. Phân tích hóa học
- Sự điện li giúp xác định tính chất của các chất trong dung dịch, từ đó áp dụng vào phân tích hóa học.
- Ứng dụng trong phương pháp chuẩn độ axit-bazơ, phân tích ion, v.v.
3. Hóa sinh và y học
- Sự điện li giúp hiểu rõ về các phản ứng hóa học trong cơ thể, từ đó ứng dụng vào y học và hóa sinh.
- Ứng dụng trong việc nghiên cứu về hoạt động enzyme, phản ứng hóa học trong cơ thể, v.v.
4. Công nghệ môi trường
- Sự điện li giúp xử lý nước thải, tái chế dung dịch, xử lý ô nhiễm môi trường.
- Ứng dụng trong công nghệ xử lý nước, xử lý chất thải công nghiệp, v.v.
5. Công nghệ vật liệu
- Sự điện li giúp tạo ra các loại vật liệu mới, từ chất điện li đến polymer dẫn điện.
- Ứng dụng trong công nghệ sản xuất vật liệu dẫn điện, vật liệu thông minh, v.v.
Những ứng dụng của sự điện li không chỉ giúp chúng ta hiểu rõ hơn về tính chất của các chất hóa học mà còn mở ra nhiều cánh cửa mới trong nghiên cứu và ứng dụng công nghệ.
Ví dụ về chất điện li mạnh và chất điện li yếu
Để hiểu rõ hơn về sự điện li, hãy xem xét một số ví dụ về chất điện li mạnh và chất điện li yếu:
Ví dụ về chất điện li mạnh: NaCl (Natri clorua)
- Khi NaCl được hòa tan trong nước, nó sẽ phân ly hoàn toàn thành ion natri (Na+) và ion clorua (Cl-).
- Độ điện li của NaCl gần như 100% do tạo ra ion tự do mạnh mẽ.
Ví dụ về chất điện li yếu: CH3COOH (Axit axetic)
- Khi CH3COOH được hòa tan trong nước, chỉ một phần nhỏ phân tử CH3COOH sẽ phân ly thành ion acetat (CH3COO-) và proton .
- Độ điện li của CH3COOH thấp, khoảng 1-5%, do chỉ một phần nhỏ phân tử bị phân ly.
Những ví dụ này cho thấy sự khác biệt rõ ràng giữa chất điện li mạnh và chất điện li yếu dựa trên độ điện li và khả năng phân ly ion.
Ý nghĩa của sự điện li
Sự điện li đóng vai trò quan trọng trong hóa học và các ngành khoa học liên quan. Ý nghĩa của sự điện li bao gồm:
- Giúp hiểu rõ về tính chất của các chất hóa học khi hòa tan trong dung môi.
- Áp dụng vào nhiều phương pháp phân tích hóa học và xác định cấu trúc hóa học.
- Mở ra nhiều ứng dụng trong công nghiệp, y học, môi trường, vật liệu, v.v.
- Đóng vai trò quan trọng trong việc nghiên cứu và phát triển các công nghệ mới.
Sự điện li không chỉ là một khái niệm trừu tượng mà còn là một công cụ quan trọng giúp con người hiểu rõ hơn về thế giới xung quanh và áp dụng vào thực tiễn đời sống.
Những lưu ý khi làm bài tập về sự điện li
Khi làm bài tập về sự điện li, hãy lưu ý một số điểm sau để đạt kết quả tốt:
- Hiểu rõ về định nghĩa và tính chất của chất điện li mạnh và chất điện li yếu.
- Biết cách tính độ điện li và áp dụng vào bài tập cụ thể.
- Xác định các yếu tố ảnh hưởng đến sự điện li và hiểu rõ về cơ chế phân ly ion.
- Thực hành nhiều bài tập để nắm vững kiến thức và kỹ năng liên quan đến sự điện li.
- Đọc thêm sách tham khảo và tìm hiểu về các ứng dụng và ý nghĩa của sự điện li trong thực tế.
Bằng việc áp dụng những lưu ý trên, bạn sẽ có cơ hội nắm vững và ứng dụng kiến thức về sự điện li một cách hiệu quả trong học tập và nghiên cứu.
Kết luận
Trên đây là một cái nhìn tổng quan về sự điện li trong hóa học, từ định nghĩa, phân loại, thuyết lý thuyết đến các ứng dụng và ý nghĩa của nó. Sự điện li không chỉ là một khái niệm cơ bản mà còn là nền tảng quan trọng giúp chúng ta hiểu rõ hơn về tính chất của các chất hóa học và áp dụng vào thực tiễn.
Hy vọng rằng bài viết này đã giúp bạn hiểu rõ hơn về sự điện li và cách áp dụng kiến thức này vào học tập và nghiên cứu. Hãy tiếp tục khám phá và ứng dụng sự điện li trong hóa học để mở ra nhiều cơ hội mới trong tương lai. Chúc bạn thành công!
Mọi thắc mắc quý khách hàng xin vui lòng gửi về số Hotline 1900.868644 hoặc địa chỉ email [email protected] để được giải đáp. Trân trọng!

















